Phương pháp sơ đồ đường chéo, Quy tắc đường chéo – Hóa học lớp 8, lớp 11
Mục Lục
Phương pháp sơ đồ đường chéo, Quy tắc đường chéo – Hóa học lớp 8, lớp 11
Phương pháp sơ đồ đường chéo là một công cụ hữu ích trong việc cân bằng phương trình hoá học. Đây là một phương pháp giúp bạn cân bằng phương trình hoá học một cách hiệu quả bằng cách sử dụng các đường chéo để thay thế hệ số của các chất tham gia và sản phẩm.
Cách sử dụng phương pháp sơ đồ đường chéo:
- Viết phương trình hoá học chưa cân bằng: Bắt đầu viết phương trình hoá học chưa cân bằng với các hệ số thể hiện số lượng các chất tham gia và sản phẩm.
- Tạo sơ đồ đường chéo: Tạo một sơ đồ gồm hai đường chéo, một từ trên xuống bên trái và một từ trên xuống bên phải. Gắn hệ số của chất tham gia lên đường chéo bên trái và hệ số của sản phẩm lên đường chéo bên phải.
- Tính tỷ lệ hệ số: Để cân bằng phương trình, bạn cần tính tỷ lệ hệ số bằng cách chia các hệ số trên đường chéo bên trái cho các hệ số trên đường chéo bên phải. Tìm ước chung lớn nhất của các tỷ lệ hệ số này.
- Cân bằng phương trình: Nhân tất cả các hệ số bên cả hai đường chéo với ước chung lớn nhất vừa tìm được. Sau đó, viết lại phương trình với các hệ số đã cân bằng.
Quy tắc đường chéo trong phương pháp sơ đồ đường chéo:
- Đường chéo bên trái thể hiện các hệ số của chất tham gia trong phản ứng hoá học chưa cân bằng.
- Đường chéo bên phải thể hiện các hệ số của sản phẩm trong phản ứng hoá học chưa cân bằng.
- Tính tỷ lệ hệ số bằng cách chia hệ số của mỗi chất trên đường chéo bên trái cho hệ số của cùng chất trên đường chéo bên phải.
Lưu ý rằng quy tắc đường chéo và phương pháp sơ đồ đường chéo là một cách tiện lợi để cân bằng phương trình hoá học. Tuy nhiên, có nhiều phương pháp cân bằng khác mà bạn cũng nên tìm hiểu như sử dụng ma trận, phương pháp đặt hệ số, và cân bằng theo dạng bù trừ.

Phương pháp sơ đồ đường chéo đem đến cho bạn cách giải những bài toán có chút phức tạp một cách nhanh gọn và đơn thuần hơn. Hãy chớp lấy rõ giải pháp này trải qua việc tìm hiểu thêm bài viết dưới đây nhé !
Phương pháp sơ đồ đường chéo là gì ?
1. Nội dung phương pháp
– Nguyên tắc : Trộn lẫn hai dung dịch :
+ ) Dung dịch 1 : có khối lượng m1, thể tích V1, nồng độ C1 ( nồng độ Tỷ Lệ hoặc nồng độ mol ), khối lượng riêng d1 .
+ ) Dung dịch 2 : có khối lượng mét vuông, thể tích V2, nồng độ C2 ( C2 > C1 ), khối lượng riêng d2 .
+ ) ung dịch thu được : có khối lượng m = m1 + mét vuông, thể tích V = V1 + V2, nồng độ C ( C1 < C < C2 ) và khối lượng riêng d .
– Sơ đồ đường chéo và công thức tương ứng với mỗi trường hợp là :
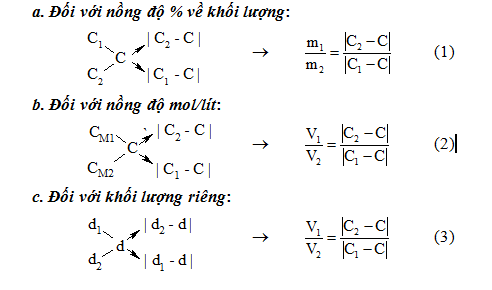
– Khi sử dụng sơ đồ đường chéo cần chú ý:
+ ) Chất rắn coi như dung dịch có C = 100 %
+ ) Dung môi coi như dung dịch có C = 0 %
+ ) Khối lượng riêng của H2O là d = 1 g / ml .
2. Khi nào bạn nên sử dụng phương pháp này ?
+ Bài toán về đồng vị: Ta áp dụng sơ đồ đường chéo cho đại lượng khối lượng phân tử và số khối
+ Bài toán hỗn hợp khí : Ta vận dụng sơ đồ đường chéo cho tỉ lệ mol tương ứng với tỉ lệ chênh lệch phân tử khối những chất so với giá trị trung bình
+ Bài toán pha chế : Ta vận dụng sơ đồ đường chéo cho những đại lượng C %, CM, d, …
+ Bài toán xác lập công thức, tính tỉ lệ những chất : Ta vận dụng cho những đại lượng, phân tử khối trung bình, số nguyên tử trung bình, … .
Bài tập minh họa phương pháp sử dụng đường chéo có đáp án
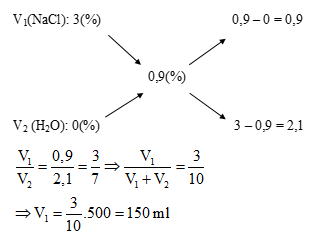
Bài tập 1: Để pha được 500 ml dung dịch nước muối sinh lí (C = 0,9%) cần lấy V ml dung dịch NaCl 3%. Giá trị của V là:
- A. 150
- B. 214,3
- C. 285,7
- D. 350
– Hướng dẫn giải:
Ta có sơ đồ :
==> Chọn đáp án A
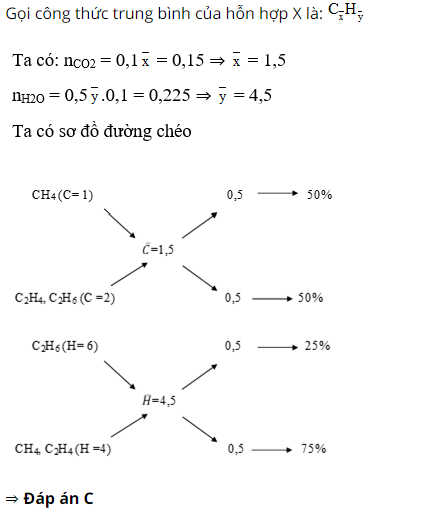
Bài tập 2: Đốt cháy 0,1 mol hỗn hợp X gồm CH4, C2H4 và C2H6, sản phẩm thu được dẫn qua bình I đựng dung dịch H2SO4 đặc bình II đựng dung dịch Ca(OH)2 dư. Sau thí nghiệm, thấy bình 2 có 15g kết tủa và khối lượng bình 2 nặng hơn khối lượng bình 1 là 2,55g. Thành phần % về thể tích của mỗi khí trong hỗn hợp là:
- A. 50%, 30%, 20%
- B. 30%, 40%, 30%
- C. 50%, 25%, 25%
- D. 50%, 15%, 35%
– Hướng dẫn giải:
Bình 1 khối lượng tăng là do hấp thụ H2O, bình 2 khối lượng tăng là do hấp thụ CO2
n CO2 = 15 : 100 = 0,15 mol
Xem thêm: Các nguyên tắc truyền máu cơ bản
⇒ m H2O = 0,15. 44 – 2,55 = 4,05 ⇒ n H2O = 0,225 mol
Cám ơn bạn đã theo dõi những nội dung trong bài viết này, chúc bạn sẽ tìm được những nội dung hữu dụng mà bạn ứng ý nhé !
Source: https://dvn.com.vn
Category: Bản Tin DVN