Quá trình đoạn nhiệt – Wikipedia tiếng Việt
Trong nhiệt động lực học, quá trình đoạn nhiệt (tiếng Anh: adiabatic process) là quá trình xảy ra mà không có sự trao đổi nhiệt hay vật chất giữa hệ và môi trường ngoài.Trong một quá trình đoạn nhiệt, năng lượng được trao đổi chỉ là công.[1][2] Quá trình đoạn nhiệt cung cấp một cơ sở khái niệm khắt khe cho lý thuyết được sử dụng để giải thích định luật 1 của nhiệt động lực học, và do đó nó là một khái niệm quan trọng trong nhiệt động lực học.
Một số quá trình hóa học và vật lý xảy ra quá nhanh đến mức chúng hoàn toàn có thể được miêu tả thuận tiện bằng thuật ngữ ” giao động đoạn nhiệt “, có nghĩa là không có đủ thời hạn để chuyển nguồn năng lượng làm nhiệt đến hoặc đi từ mạng lưới hệ thống. [ 3 ]Ví dụ, nhiệt độ ngọn lửa đoạn nhiệt là một sáng tạo độc đáo sử dụng ” xê dịch nhiệt ” để phân phối một phép tính số lượng giới hạn trên của nhiệt độ tạo ra bởi sự đốt cháy của nguyên vật liệu. Nhiệt độ ngọn lửa đoạn nhiệt là nhiệt độ hoàn toàn có thể đạt được một bởi ngọn lửa nếu quá trình đốt cháy diễn ra mà không mất nhiệt so với môi trường tự nhiên xung quanh .
Một quá trình không liên quan đến việc chuyển nhiệt hoặc vật chất vào hoặc ra khỏi hệ thống, do đó ΔQ = 0, được gọi là quá trình đoạn nhiệt, và một hệ thống như vậy được cho là bị cô lập về đoạn nhiệt.[4][5] Giả định rằng một quá trình đoạn nhiệt là một giả định đơn giản hóa được thực hiện. Ví dụ, nén khí trong một xi-lanh của động cơ được cho là xảy ra quá nhanh đến mức quy trình thời gian của quá trình nén, ít năng lượng của hệ thống có thể được chuyển ra như là nhiệt đến môi trường xung quanh. Mặc dù các xi-lanh không được cách nhiệt và có tính dẫn điện cao, quá trình này được lý tưởng hóa để tạo ra sự dễ bay hơi. Điều tương tự có thể được nói là đúng đối với quá trình mở rộng của hệ thống như vậy.
Bạn đang đọc: Quá trình đoạn nhiệt – Wikipedia tiếng Việt
Giả định rằng việc cô lập đoạn nhiệt một hệ thống là việc hữu ích, và chúng thường được kết hợp với nhau để tính toán diễn biến có thể của hệ. Những giả định như vậy là lý tưởng hoá. Hành vi của các máy móc thực tế lệch đi khỏi những lý tưởng hóa này, nhưng giả định về hành vi “tuyệt vời” như vật của hệ cung cấp ước lượng hữu ích đầu tiên về cách thế giới thực hoạt động. Theo Laplace, khi âm thanh di chuyển trong một chất khí, không có nhiệt bị mất đi và sự truyền âm thanh là đoạn nhiệt. Với một quá trình đoạn nhiệt như vậy, mô đun đàn hồi (suất Young) có thể diễn tả là E = γP, với γ là tỷ lệ tỷ nhiệt tại một áp suất không đổi và thể tích không đổi (γ = Cp/Cv) và P là áp suất của chất khí.
Mục Lục
Các ứng dụng của giả định đoạn nhiệt[sửa|sửa mã nguồn]
Với một hệ kín, có thể viết định luật một nhiệt động lực học là: ΔU = Q + W, với ΔU là thay đổi nội năng của hệ (Q) là lượng năng lượng thêm vào dưới dạng nhiệt, và W là công tác dụng vào nó bởi môi trường xung quanh.
- Nếu hệ có tường cứng đến mức mà công không thể được truyền ra hoặc vào (
W = 0
), và tường của hệ không đoạn nhiệt và năng lượng được thêm vào dưới dạng nhiệt (
Q > 0
), và không có thay đổi pha nào, nhiệt độ của hệ sẽ tăng.
- Nếu hệ có tường cứng đến mức mà công áp suất-thể tích không thể được thực hiện, và tường của hệ đoạn nhiệt (
Q = 0
), nhưng năng lượng được được thêm vào là công đẳng tích dưới dạng ma sát hoặc sự khuấy của chất lưu nhớt trong hệ (
W > 0
), và không có thay đổi pha, nhiệt độ của hệ sẽ tăng.
- Nếu tường của hệ đoạn nhiệt (
Q = 0
), nhưng không cứng (
W ≠ 0
), cà, trong một quá trình tiêu chuẩn hóa tưởng tượng, năng lượng được thêm vào hệ dưới dạng không ma sát, công áp suất-thể tính không nhớt, và không có thay đổi pha, nhiệt độ của hệ sẽ tăng lên. Quá trình như vật được gọi là đẳng entropy và được cho là “thuận nghịch”. Một cách tưởng tượng, nếu quá trình được đảo ngược, năng lượng thêm vào dưới dạng công có thể hồi phục hoàn toàn dưới dạng công thực hiện bởi hệ. Nếu hệ chứa khí có thể giám và giảm thể tích, sai số vị trí của khí sẽ giảm, và có vẻ sẽ giảm entropy của hệ, nhưng nhiệt độ của hệ sẽ tăng vì quá trình này đẳng entropy (
ΔS = 0
). Nếu công được thêm vào thêm một cách mà lực ma sát hoặc nhớt đang hoạt động trong hệ, thì quá trình không đẳng entropy, và nếu không có thay đổi pha, nhiệt độ của hệ sẽ tăng, mà quá trình được cho là “không thuận nghịch”, và công thêm vào hệ không hoàn toàn có thể hồi phục dưới dạng công.
- Nếu tường của hệ không đoạn nhiệt, và năng lượng được truyền dưới dạng nhiệt, entropy được truyền vào hệ với nhiệt. Quá trình như vậy không đoạn nhiệt hay đẳng entropy, có
Q > 0
và
ΔS > 0
theo định luật hai nhiệt động lực học.
Quá trình đoạn nhiệt xảy ra tự nhiên không thuận nghịch (entropy được tạo ra). Sự truyền năng lượng dưới dạng nhiệt vào một hệ bị cô lập đoạn nhiệt có thể tưởng tượng là hai loại tột cùng lý tưởng hóa. Trong một loại như vậy one such kind, không có entropy được tạo ra trong hệ (không ma sát, phân tán nhớt, v.v), và công chỉ là công áp suất-thể tích (diễn tả bởi P dV). Trong tự nhiên, loại lý tưởng này chỉ xảy ra xấp xỉm bởi vì nó tần một quá trình chậm vô hạn và không có nguồn phân tán.
Loại thứ hai là công tột cùng dưới dạng công đẳng tích (dV = 0), trong đó năng lượng được thêm vào dưới dạng công chỉ qua ma sát hoặc phân tán nhớt trong hệ. Một máy khuấy truyền năng lượng đến một chất lưu nhớt của một hệ bị cô lập đoạn nhiệt với tường cứng, không có thay đổi pha, sẽ làm tăng nhiệt độ của chất lưu, nhưng công này không phục hồi được. Công đẳng tích không thuận nghịch.[6] Định luật hai nhiệt động lực học quan sát rằng một quá trình tự nhiên của sự truyền nhiệt dưới dạng công, luôn bao gồm ít nhất công đẳng tích và tường có cả hai loại công tột cùng. Mỗi quá trình tự nhiên, kể cả đoạn nhiệt hay không, đều không thuận nghịch, với ΔS > 0, vì ma sát hoặc độ nhớt luôn tồn tại tới một mức độ nào đó.
Làm nóng và làm lạnh đoạn nhiệt[sửa|sửa mã nguồn]
Sự nén đoạn nhiệt của khí làm tăng nhiệt độ của khí. Giãn nở đoạn nhiệt phản ứng lại áp suất, hoặc co lại nếu nhiệt độ giảm. Ngược lại, co và giãn tự do là một quá trình đẳng nhiệt so với khí lý tưởng .
Làm nóng đoạn nhiệt xảy ra khi áp suất của khí tăng do công tác dụng vào nó bởi những thứ xung quanh, vd: một cái piston nén khí trong một hình trụ đoạn nhiệt. Ứng dụng thực tế của việc này trong động cơ Diesel mà dựa vào sự thiếu tản nhiệt nhanh trong quá trình nén để tăng nhiệt độ nhiên liệu khí đủ để đốt cháy nó.
Làm nóng đoạn nhiệt xảy ra trong khí quyển Trái Đất khi một khối khí vận động và di chuyển xuống, ví dụ, trong một gió thổi xuống, gió foehn, hoặc gió chinook thổi xuống đồi qua một dãy núi. Khi một khối khí chuyển dời xuống, áp suất vào khối khí tăng lên. Do áp suất tăng lên, thể tích khối khí giảm và nhiệt độ của nó tăng khi công được công dụng vào khối khí, do đó làm tăng nội năng của nó, biểu lộ bằng sự ngày càng tăng nhiệt độ của khối khí đó. Khối khí chỉ hoàn toàn có thể giải phóng nguồn năng lượng từ từ bằng dẫn truyền hoặc bức xạ ( nhiệt ), và với một giao động khởi đầu nó hoàn toàn có thể được coi là bị cô lập đoạn nhiệt và quá trình này được coi là quá trình đoạn nhiệt .
Làm lạnh đoạn nhiệt xảy ra khi áp suất lên một hệ bị cô lập đoạn nhiệt giảm xuống, khiến nó giãn nở, do đó khiến nó tác dụng lực vào môi trường xung quanh. Khi áp suất tác dụng vào một khối khí giảm đi, lượng khí trong khối nở ra; khi thể tích tăng lên, nhiệt độ giảm đi vì nội năng của nó giảm đi. Làm lạnh đoạn nhiệt xảy ra trong khí quyển Trái Đất với sự nâng địa hình và sóng lee, và nó có thể tạo thành mây pileus hoặc mây dạng thấu kính.
Làm lạnh đoạn nhiệt không cần phải tương quan đến một chất lưu. Một kỹ thuật được sử dụng để đạt được nhiệt độ rất thấp ( hàng nghìn và thậm chí còn hàng triệu độ trên nhiệt độ không tuyệt đối ) qua sự khử từ đoạn nhiệt, nơi có biến hóa trong từ trường lên một vật tư từ được sử dụng để tạo ra làm lạnh đoạn nhiệt. Ngoài ra, thành phần của thiên hà co và giãn hoàn toàn có thể được diễn đạt ( đến bậc tiên phong ) là một chất lưu làm lạn đoạn nhiệt. ( xem cái chết nhiệt của thiên hà. )Macma ngày càng tăng cũng trải qua làm lạnh đoạn nhiệt trước khi phun trào, đặc biệt quan trọng quan trọng trong trường hợp macma tăng nhanh từ độ sâu lớn như kimberlite. [ 7 ]Thay đổi nhiệt độ như vật hoàn toàn có thể được định lượng bằng cách sử dụng phương trình trạng thái khí lý tưởng, hoặc phương trình thủy tĩnh so với những quá trình khí quyển .Trong thực tiễn, không có quá trình nào là thực sự đoạn nhiệt. Nhiều quá trình dựa vào một sự chênh lệch lớn về quy mô thời hạn của quá trình được chăm sóc và vận tốc tản nhiệt qua ranh giới của hệ, và do đó được ước đạt bằng cách sử dụng một giả định đoạn nhiệt. Luôn luôn có sự mất nhiệt, vì không có chất cách ly nào tuyệt vời và hoàn hảo nhất .
Khí lý tưởng ( quá trình thuận nghịch )[sửa|sửa mã nguồn]
 Đối với một chất đơn thuần, trong quá trình đoạn nhiệt mà thể tích tăng lên, nội năng của chất thao tác phải giảmCông thức toán học cho một khí lý tưởng trải qua một có trình đoạn nhiệt thuận nghịch ( không tạo ra entropy ) hoàn toàn có thể diễn đạt bằng phương trình quá trình đa hướng [ 3 ]
Đối với một chất đơn thuần, trong quá trình đoạn nhiệt mà thể tích tăng lên, nội năng của chất thao tác phải giảmCông thức toán học cho một khí lý tưởng trải qua một có trình đoạn nhiệt thuận nghịch ( không tạo ra entropy ) hoàn toàn có thể diễn đạt bằng phương trình quá trình đa hướng [ 3 ]
- P. V n = { \ displaystyle PV ^ { n } = }{ \ displaystyle \ qquad }
trong đó P là áp suất, V là thể tích, và đối với trường hợp này n = γ với
- γ = C P C V = f + 2 f, { \ displaystyle \ gamma = { C_ { P } \ over C_ { V } } = { \ frac { f + 2 } { f } }, }
CP là tỷ nhiệt đối với áp suất không đổi, CV là tỷ nhiệt của thể tích không đổi, γ là chỉ số đoạn nhiệt, và f là số mức độ tự do (3 đối với khí đơn nguyên, 5 đối với khí lưỡng nguyên và các phân tử thẳng hàng v.d. cacbon dioxide).
Đối với một khí lý tưởng đơn nguyên, γ = 5/3, và đối với khí lưỡng nguyên (như là nitơ và ôxi, thành phần chính của không khí) γ = 7/5.[8] Chú ý rằng công thức trên chỉ áp dụng với khí lý tưởng cổ điển và không áp dụng với khí Bose–Einstein hoặc Fermi.
Đối với quá trình đoạn nhiệt thuận nghịch, điều sau đây cũng đúng
- P. 1 − γ T γ = { \ displaystyle P. ^ { 1 – \ gamma } T ^ { \ gamma } = }
[3]
- V T f 2 = { \ displaystyle VT ^ { \ frac { f } { 2 } } = }
với T là nhiệt độ tuyệt đối. Nó có thể viết dưới dạng
- T V γ − 1 = { \ displaystyle TV ^ { \ gamma – 1 } = }
[3]
Ví dụ về nén đoạn nhiệt[sửa|sửa mã nguồn]
Hành trình nén trong một động cơ ga có thể được sử dụng làm một ví dụ về sự nén đoạn nhiệt. Giả định mô hình là: thể tích chưa nén của hình trụ là 1 lít (1 l = 1000 cm3 = 0,001 m3); phần khí trong không khí chỉ bao gồm phân tử ni tơ và ôxi (do đó khí lưỡng nguyên có năm bậc tự do và vậy nên γ = 7/5); Tỷ lệ nén của động cơ là 10:1 (nghĩa là, 1 l thể tích khí không nén bị giảm xuống 0,1 l bởi piston); và khí không né ở nhiệt độ phòng và áp suất (nhiệt độ phòng ấm ~27 °C hoặc 300 K, và áp suất 1 bar = 100 kPa, vd: áp suất khí quyển điển hình tại mực nước biển).
- P V γ = { \ displaystyle PV ^ { \ gamma } = }
1 = 100, 000 Pa × ( 0.001 m 3 ) 7 5 = 10 5 × 6, 31 × 10 − 5 Pa m 21 / 5 = 6, 31 Pa m 21 / 5 { \ displaystyle = 100,000 \ operatorname { Pa } \ times ( 0.001 \ operatorname { m } ^ { 3 } ) ^ { \ frac { 7 } { 5 } } = 10 ^ { 5 } \ times 6,31 \ times 10 ^ { – 5 } \ operatorname { Pa } \ operatorname { m } ^ { 21/5 } = 6,31 \ operatorname { Pa } \ operatorname { m } ^ { 21/5 } }
vậy giá trị hằng số đoạn nhiệt của ví dụ này là khoảng chừng 6,31 Pa m4, 2 .Chất khí giờ đây bị nén đến thể tích 0,1 l ( 0,0001 m3 ) ( cho rằng việc này xảy ra đủ nhah để không có nhiệt được truyền vào hoặc đi ra khỏi chất khí qua tường ). Hằng số đoạn nhiệt vẫn không đổi, nhưng tác dụng của áp suất không xác lập
- P V γ = { \ displaystyle PV ^ { \ gamma } = }1 = 6, 31 Pa m 21 / 5 = P × ( 0.0001 m 3 ) 7 5 { \ displaystyle = 6,31 \ operatorname { Pa } \ operatorname { m } ^ { 21/5 } = P \ times ( 0.0001 \ operatorname { m } ^ { 3 } ) ^ { \ frac { 7 } { 5 } } }
ta có P. :
- P. = 6, 31 Pa m 21 / 5 ( 0, 0001 m 3 ) 7 5 = 6, 31 Pa m 21 / 5 2, 5 × 10 − 6 m 21 / 5 = 2, 51 × 10 6 Pa { \ displaystyle P = { \ frac { 6,31 \ operatorname { Pa } \ operatorname { m } ^ { 21/5 } } { ( 0,0001 \ operatorname { m } ^ { 3 } ) ^ { \ frac { 7 } { 5 } } } } = { \ frac { 6,31 \ operatorname { Pa } \ operatorname { m } ^ { 21/5 } } { 2,5 \ times 10 ^ { – 6 } \ operatorname { m } ^ { 21/5 } } } = 2,51 \ times 10 ^ { 6 } \ operatorname { Pa } }
hoặc 25,1 bar. Chú ý rằng áp suất này hoàn toàn có thể tăng nhiều hơn là tương ứng với tỷ suất nén đơn thuần 10 : 1 ; điều này là do tại khí không chỉ bị nèn, mà công thực thi để nén khí cũng làm tăng nội năng của nói bộc lộ bởi việc tăng nhiệt độ khí và một sự tăng áp suất vượt lên hiệu quả mà một đo lường và thống kê đơn thuần là 10 lần áp suất khởi đầu sẽ đưa ra .Chúng ta có cũng thể giải để tìm nhiệt độ của khí nén trong động cơ hình tròn trụ, bằng cách sử dụng định luật khí lý tưởng, PV = nRT ( n là lượng khí trong mol và R là hằng số khí của khí ). Điều kiện bắt đầu của tất cả chúng ta là áp suất 100 kPa, thể tích 1 l, và nhiệt độ 300 K, hằng số thí nghiệm của tất cả chúng ta ( = nR ) là :
- P. V T = { \ displaystyle { PV \ over T } = }
2 = 10 5 Pa × 10 − 3 m 3 300 K = 0, 333 Pa m 3 K − 1 { \ displaystyle = { { 10 ^ { 5 } \ operatorname { Pa } \ times 10 ^ { – 3 } \ operatorname { m } ^ { 3 } } \ over { 300 \ operatorname { K } } } = 0,333 \ operatorname { Pa } \ operatorname { m } ^ { 3 } \ operatorname { K } ^ { – 1 } }
Ta biết khí nén có V = 0,1 l và P = 2,51 × 106 Pa, nên ta hoàn toàn có thể giải để tìm nhiệt độ :
- T = P V / { \ displaystyle T = PV / }
2 = 2.51 × 10 6 Pa × 10 − 4 m 3 0, 333 Pa m 3 K − 1 = 753 K { \ displaystyle = { { 2.51 \ times 10 ^ { 6 } \ operatorname { Pa } \ times 10 ^ { – 4 } \ operatorname { m } ^ { 3 } } \ over { 0,333 \ operatorname { Pa } \ operatorname { m } ^ { 3 } \ operatorname { K } ^ { – 1 } } } = 753 \ operatorname { K } }
Nhiệt độ ở đầu cuối là 753 K, hoặc 479 °C, hoặc 896 °F, nhiều hơn nhiệt độ độ cháy của nhiều nguyên vật liệu. Đây là nguyên do vì sao động cơ nén cao cần nguyên vật liệu được sản xuất đặc biệt quan trọng để không tự đốt cháy ( mà sẽ gây ra sự roóc máy khi quản lý và vận hành dưới điều kiện kèm theo nhiệt độ và áp suất này ), hoặc một bộ siêu nạp với một thiết bị làm mát chất lỏng để làm tăng cao áp suất nhưng tăng ít nhiệt độ hơn sẽ tạo ra lợi thế. Động cơ Diesel còn quản lý và vận hành kể cả dưới điều kiện kèm theo khắc nghiệt hơn, với tỷ suất nén nổi bật là 20 : 1 hoăc nhiều hơn, để tạo ra nhiệt độ khí rất cao mà bảo vệ đốt cháy nguyên vật liệu bơm vào ngay lập tức .
Giãn nở tự do đoạn nhiệt của khí[sửa|sửa mã nguồn]
Đối với sự co và giãn tự do đoạn nhiệt của khí lý tưởng, khí được chứa trong một vật chứa cách ly và hoàn toàn có thể co và giãn trong chân không. Vì không có áp lực đè nén bên ngoài nào khiến khí nở ra, công thực thi bởi hoặc vào hệ bằng không. VÌ quá trình này không tương quan đến truyền nhiệt hoặc công, định luật một nhiệt động lực học chỉ ra rằng tổng biến hóa nội năng của hệ bằng không. Đối với một khí lý tưởng, nhiệt độ vẫn không đổi vì nội năng chỉ phụ thuộc vào vào nhiệt độ trong trường hợp đó. Bởi vì ở nhiệt độ không đổi, entropy tỷ suất với thể tích, entropy tăng lên trong trường hợp này, do đó quá trình này không thuận nghịch .
Chứng minh quan hệ P–V đối với làm nóng và làm lạnh đoạn nhiệt
[sửa|sửa mã nguồn]
Định nghĩa quá trình đoạn nhiệt là nhiệt truyền vào hệ bằng không, δQ = 0. Vậy nên, theo định luật một nhiệt động lực học,
- ( 1 ) d U + δ W = δ Q = 0, { \ displaystyle { \ text { ( 1 ) } } \ qquad dU + \ delta W = \ delta Q = 0, }
với dU là thay đổi trong nội năng của hệ và δW là công tác dụng bởi hệ. Bất cứ công (δW) nào được tác dụng phải là do nội năng U, vì không có nhiệt δQ được cung cấp từ xung quanh. Công tác dụng bở áp suất–thể tích δW của hệ được định nghĩa là
- ( 2 ) δ W = P d V. { \ displaystyle { \ text { ( 2 ) } } \ qquad \ delta W = P \, dV. }
Tuy nhiên, P không phải hằng số trong quá trình đoạn nhiệt mà thay vào đó nó thay đổi cùng với V.
Chúng ta muốn biết các giá trị dP và dV liên quan đến nhau thế nào khi quá trình đoạn nhiệt diễn ra. Đối với khí lý tưởng nội năng là
- ( 3 ) U = α n R T, { \ displaystyle { \ text { ( 3 ) } } \ qquad U = \ alpha nRT, }
với α là số bậc tự do chia hai, R là hằng số khí và n là số mol trong hệ (một hằng số).
Đạo hàm phương trình (3) và sử dụng định luật khí lý tưởng, PV = nRT, ta có
Xem thêm: Dude là gì? Dude có ý nghĩa gì? Dude được sử dụng như thế nào? – Trường THPT Thành Phố Sóc Trăng
- ( 4 ) d U = α n R d T = α d ( P V ) = α ( P. d V + V d P. ). { \ displaystyle { \ text { ( 4 ) } } \ qquad dU = \ alpha nR \, dT = \ alpha \, d ( PV ) = \ alpha ( P \, dV + V \, dP ). }
Phương trình (4) thường được diễn tả là dU = nCV dT vì CV = αR.
Bây giờ thay thế sửa chữa ( 2 ) và ( 4 ) vào phương trình ( 1 ) ta có
- − P. d V = α P. d V + α V d P., { \ displaystyle – P \, dV = \ alpha P \, dV + \ alpha V \, dP, }
thừa số chung −P dV:
- − ( α + 1 ) P. d V = α V d P., { \ displaystyle – ( \ alpha + 1 ) P \, dV = \ alpha V \, dP, }
và chia cả hai vế với PV:
- − ( α + 1 ) d V V = α d P P. { \ displaystyle – ( \ alpha + 1 ) { dV \ over V } = \ alpha { dP \ over P }. }
Sau khi tích phân vế trái và phải từ V0 đến V và từ P0 đến P và lần lượt thay đổi từng vế,
- ln ( P P 0 ) = − α + 1 α ln ( V V 0 ). { \ displaystyle \ ln \ left ( { P \ over P_ { 0 } } \ right ) = { – { \ alpha + 1 \ over \ alpha } } \ ln \ left ( { V \ over V_ { 0 } } \ right ). }
Mũ hóa cả hai vế, và thay α + 1/α với γ, tỷ lệ tỷ nhiệt
- ( P P 0 ) = ( V V 0 ) − γ, { \ displaystyle \ left ( { P \ over P_ { 0 } } \ right ) = \ left ( { V \ over V_ { 0 } } \ right ) ^ { – { \ gamma } }, }
và vô hiệu dấu trừ để có
- ( P P 0 ) = ( V 0 V ) γ. { \ displaystyle \ left ( { P \ over P_ { 0 } } \ right ) = \ left ( { V_ { 0 } \ over V } \ right ) ^ { \ gamma }. }
Do đó ,
- ( P P 0 ) ( V V 0 ) γ = 1 { \ displaystyle \ left ( { P \ over P_ { 0 } } \ right ) \ left ( { V \ over V_ { 0 } } \ right ) ^ { \ gamma } = 1 }
và
- P. 0 V 0 γ = P V γ = { \ displaystyle P_ { 0 } V_ { 0 } ^ { \ gamma } = PV ^ { \ gamma } = }
Chứng minh quan hệ P–T đối với làm nóng và làm lạnh đoạn nhiệt
[sửa|sửa mã nguồn]
Thay định luật khí lý tưởng vào phần trên, ta có
- P. ( n R T P ) γ = { \ displaystyle P \ left ( { \ frac { nRT } { P } } \ right ) ^ { \ gamma } = }
Giản ước thành
- P. ( 1 − γ ) T γ = { \ displaystyle P ^ { ( 1 – \ gamma ) } T ^ { \ gamma } = }
Chứng minh phương trình rời rạc[sửa|sửa mã nguồn]
Sự đổi khác trong nội năng của một hệ, được đo từ trạng thái 1 đến trạng thái 2, bằng
- ( 1 ) Δ U = α R n T 2 − α R n T 1 = α R n Δ T { \ displaystyle { \ text { ( 1 ) } } \ qquad \ Delta U = \ alpha RnT_ { 2 } – \ alpha RnT_ { 1 } = \ alpha Rn \ Delta T }
Cùng lúc đó, tác dụng của quá trình này là công thực thi bởi áp suất-thể tích biến hóa, bằng
- ( 2 ) W = ∫ V 1 V 2 P. d V { \ displaystyle { \ text { ( 2 ) } } \ qquad W = \ int _ { V_ { 1 } } ^ { V_ { 2 } } P \, dV }
Vì ta muốn quá trình này đoạn nhiệt, phương trình sau phải đúng
- ( 3 ) Δ U + W = 0 { \ displaystyle { \ text { ( 3 ) } } \ qquad \ Delta U + W = 0 }
Bằng chứng minh trước đây ,
- ( 4 ) P V γ = { \ displaystyle { \ text { ( 4 ) } } \ qquad PV ^ { \ gamma } = }
= P. 1 V 1 γ { \ displaystyle = P_ { 1 } V_ { 1 } ^ { \ gamma } }
Chuyển vế ( 4 ) ta có
- P. = P. 1 ( V 1 V ) γ { \ displaystyle P = P_ { 1 } \ left ( { \ frac { V_ { 1 } } { V } } \ right ) ^ { \ gamma } }
Thay vào ( 2 ) ta có
- W = ∫ V 1 V 2 P. 1 ( V 1 V ) γ d V { \ displaystyle W = \ int _ { V_ { 1 } } ^ { V_ { 2 } } P_ { 1 } \ left ( { \ frac { V_ { 1 } } { V } } \ right ) ^ { \ gamma } \, dV }
Tích phân ,
- W = P. 1 V 1 γ V 2 1 − γ − V 1 1 − γ 1 − γ { \ displaystyle W = P_ { 1 } V_ { 1 } ^ { \ gamma } { \ frac { V_ { 2 } ^ { 1 – \ gamma } – V_ { 1 } ^ { 1 – \ gamma } } { 1 – \ gamma } } }
Thay γ = α + 1/α,
- W = − α P. 1 V 1 γ ( V 2 1 − γ − V 1 1 − γ ) { \ displaystyle W = – \ alpha P_ { 1 } V_ { 1 } ^ { \ gamma } \ left ( V_ { 2 } ^ { 1 – \ gamma } – V_ { 1 } ^ { 1 – \ gamma } \ right ) }
Sắp xếp lại ,
- W = − α P. 1 V 1 ( ( V 2 V 1 ) 1 − γ − 1 ) { \ displaystyle W = – \ alpha P_ { 1 } V_ { 1 } \ left ( \ left ( { \ frac { V_ { 2 } } { V_ { 1 } } } \ right ) ^ { 1 – \ gamma } – 1 \ right ) }
Sử dụng định luật khí lý tưởng và giả sử có một lượng thành phần gam không đổi ( như thường xảy ra trong trong thực tiễn ) ,
- W = − α n R T 1 ( ( V 2 V 1 ) 1 − γ − 1 ) { \ displaystyle W = – \ alpha nRT_ { 1 } \ left ( \ left ( { \ frac { V_ { 2 } } { V_ { 1 } } } \ right ) ^ { 1 – \ gamma } – 1 \ right ) }
Do đó ,
- P. 2 P. 1 = ( V 2 V 1 ) − γ { \ displaystyle { \ frac { P_ { 2 } } { P_ { 1 } } } = \ left ( { \ frac { V_ { 2 } } { V_ { 1 } } } \ right ) ^ { – \ gamma } }
Hay ,
- ( P. 2 P. 1 ) − 1 γ = V 2 V 1 { \ displaystyle \ left ( { \ frac { P_ { 2 } } { P_ { 1 } } } \ right ) ^ { – 1 \ over \ gamma } = { \ frac { V_ { 2 } } { V_ { 1 } } } }
Thay vào phương trình trước đó của W,
- W = − α n R T 1 ( ( P. 2 P. 1 ) γ − 1 γ − 1 ) { \ displaystyle W = – \ alpha nRT_ { 1 } \ left ( \ left ( { \ frac { P_ { 2 } } { P_ { 1 } } } \ right ) ^ { \ frac { \ gamma – 1 } { \ gamma } } – 1 \ right ) }
Thay ( 1 ) và ( 3 ) vào phương trình này ta có
- α n R ( T 2 − T 1 ) = α n R T 1 ( ( P. 2 P. 1 ) γ − 1 γ − 1 ) { \ displaystyle \ alpha nR ( T_ { 2 } – T_ { 1 } ) = \ alpha nRT_ { 1 } \ left ( \ left ( { \ frac { P_ { 2 } } { P_ { 1 } } } \ right ) ^ { \ frac { \ gamma – 1 } { \ gamma } } – 1 \ right ) }
Giản ước ,
- T 2 − T 1 = T 1 ( ( P. 2 P. 1 ) γ − 1 γ − 1 ) { \ displaystyle T_ { 2 } – T_ { 1 } = T_ { 1 } \ left ( \ left ( { \ frac { P_ { 2 } } { P_ { 1 } } } \ right ) ^ { \ frac { \ gamma – 1 } { \ gamma } } – 1 \ right ) }
Giản ước ,
- T 2 T 1 − 1 = ( P. 2 P. 1 ) γ − 1 γ − 1 { \ displaystyle { \ frac { T_ { 2 } } { T_ { 1 } } } – 1 = \ left ( { \ frac { P_ { 2 } } { P_ { 1 } } } \ right ) ^ { \ frac { \ gamma – 1 } { \ gamma } } – 1 }
Giản ước ,
- T 2 = T 1 ( P. 2 P. 1 ) γ − 1 γ { \ displaystyle T_ { 2 } = T_ { 1 } \ left ( { \ frac { P_ { 2 } } { P_ { 1 } } } \ right ) ^ { \ frac { \ gamma – 1 } { \ gamma } } }
Vẽ đồ thị đường đoạn nhiệt[sửa|sửa mã nguồn]
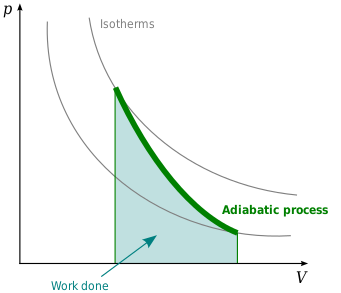
Một đường đoạn nhiệt là một đường cong với entropy không đổi trên biểu đồ P–V. Một số tính chất của đường đoạn nhiệt trên ‘biểu đồ ‘P–V được chỉ ra. Những tính chất này có thể được đọc từ hành vi cổ điển của khí lý tưởng, trừ trong vùng mà PV trở nên nhỏ (nhiệt độ thấp), nơi hiệu ứng lượng tử trở nên quan trọng.
- Mỗi đường đoạn nhiệt tiến đến một cách tiệm cận cả trục V và trục P (giống như đường đẳng nhiệt).
- Mỗi đường đoạn nhiệt cắt đường đẳng nhiệt đúng một lần.
- Đường đoạn nhiệt nhìn giống đường đẳng nhiệt, từ trong quá trình giãn nỡ, đường đoạn nhiệt mất nhiều áp suất hơn đường đẳng nhiệt, nên nó có độ nghiêng dốc hơn (thẳng hơn).
- Nếu đường đẳng nhiệt lõm về phía đông bắc (45°), thì đường đoạn nhiệ lõm về phía đông đông bắc (31°).
- Nếu đường đoạn nhiệt và đường đẳng nhiệt được vẽ với các khoảng thời gian đều đặn của entropy và nhiệt độ, lần lượt (như cao độ trong bản đồ đường đồng mức), thì khi mắt di chuyển về phía trục (về phía tây nam), mật độ của đường đẳng nhiệt không đổi, nhưng mật độ của đường đoạn nhiệt tăng lên. Trường hợp ngoại lệ là rất gần nhiệt độ không tuyệt đối, nơi mật độ đường đoạn nhiệt giảm mạnh và trửo nên hiếm (xem Định lý Nernst).
Sơ đồ sau đây là sơ đồ P-V với sự chồng chất của những đường đoạn nhiệt và đẳng nhiệt :
Đường đẳng nhiệt là đường đỏ và đường đoạn nhiệt là đường đen .
Đường đoạn nhiệt là đẳng entropy.
Thể tích là trục hoành và áp suất là trục tung .
Trong tiếng Anh, đoạn nhiệt là adiabatic , nghĩa đen là ‘không để bị đi qua’. Nó hình thành từ từ phủ định ἀ- (“không”) của Hy Lạp cổ đại và διαβατός, “có thể bị đi qua”, có nguồn gốc từ διά (“qua”), và βαῖνειν (“đi”), tạo thành từ ἀδιάβατος.[9] Theo Maxwell,[10] và Partington,[11] thuật ngữ này được Rankine giới thiệu.[12]
Nguồn gốc từ nguyên ở đây diễn tả sự truyền năng lượng bằng nhiệt và truyền vật chất qua tường không thể xảy ra.
Source: https://dvn.com.vn
Category: Hỏi Đáp