Insulin – Wikipedia tiếng Việt
 Insulin là một hormone peptide chứa hai chuỗi link chéo bởi những cầu nối disulfide .
Insulin là một hormone peptide chứa hai chuỗi link chéo bởi những cầu nối disulfide .
Insulin ( ,[1][2] từ Latin insula, nghĩa đen: ‘đảo’) là một hormone peptide được sản xuất bởi các tế bào beta của đảo tụy; nó được coi là hormone đồng hóa chính của cơ thể.[3] Nó điều chỉnh sự chuyển hóa carbohydrate, chất béo và protein bằng cách thúc đẩy sự hấp thụ glucose từ máu vào tế bào gan, mỡ và cơ xương.[4] Trong các mô này, glucose được hấp thụ được chuyển đổi thành glycogen thông qua glycogenesis hoặc chuyển hóa axit béo (triglyceride) thông qua quá trình lipogenesis, hoặc, trong trường hợp của gan, thông qua cả hai quá trình.[4] Sự sản xuất và bài tiết glucose của gan bị ức chế mạnh mẽ bởi nồng độ insulin cao trong máu.[5] Insulin lưu hành cũng ảnh hưởng đến quá trình tổng hợp protein trong nhiều loại mô. Do đó, nó là một hormone đồng hóa, thúc đẩy quá trình chuyển đổi các phân tử nhỏ trong máu thành các phân tử lớn bên trong các tế bào. Nồng độ insulin thấp trong máu có tác dụng ngược lại bằng cách thúc đẩy quá trình dị hóa lan rộng, đặc biệt là mỡ cơ thể dự trữ.
Các tế bào beta rất nhạy cảm với lượng đường trong máu để chúng tiết ra insulin vào máu để cung ứng với mức glucose cao ; và ức chế bài tiết insulin khi nồng độ glucose thấp. [ 6 ] Insulin tăng cường hấp thu glucose và chuyển hóa trong những tế bào, do đó làm giảm lượng đường trong máu. Các tế bào alpha lân cận của chúng, bằng cách lấy tín hiệu từ những tế bào beta, [ 6 ] tiết glucagon vào máu theo cách ngược lại : tăng tiết khi glucose trong máu thấp và giảm bài tiết khi nồng độ glucose cao. Glucagon làm tăng mức đường huyết bằng cách kích thích glycogenolysis và gluconeogenesis ở gan. [ 4 ] [ 6 ] Sự tiết insulin và glucagon vào máu để cung ứng với nồng độ glucose trong máu là chính sách chính của cân đối nội môi glucose. [ 6 ]
Giảm hoặc mất hoạt động của insulin dẫn đến đái tháo đường, một tình trạng của lượng đường trong máu cao (tăng đường huyết). Có hai loại bệnh. Trong đái tháo đường týp 1, các tế bào beta bị phá hủy bởi phản ứng tự miễn dịch để insulin không còn có thể được tổng hợp hoặc tiết vào máu.[7] Trong đái tháo đường týp 2, sự phá hủy các tế bào beta ít rõ rệt hơn so với bệnh tiểu đường loại 1, và không phải do quá trình tự miễn dịch. Thay vào đó, có sự tích tụ amyloid trong các đảo nhỏ tụy, có khả năng phá vỡ giải phẫu và sinh lý của chúng.[6] Cơ chế bệnh sinh của bệnh tiểu đường loại 2 chưa được hiểu rõ nhưng giảm dân số tế bào beta, giảm chức năng bài tiết của các tế bào beta nhỏ tồn tại và kháng insulin mô ngoại biên có liên quan.[3] Bệnh tiểu đường loại 2 được đặc trưng bởi sự tăng tiết glucagon không bị ảnh hưởng và không đáp ứng với nồng độ glucose trong máu. Nhưng insulin vẫn được tiết vào máu để đáp ứng với đường huyết.[6] Kết quả là glucose tích lũy trong máu.
Bạn đang đọc: Insulin – Wikipedia tiếng Việt
Protein insulin của con người có công thức là C 257 H 383 N 65 O 77 S 6 gồm có 51 amino acid và có khối lượng phân tử là 5808 Da. Nó là một dimer hetero của chuỗi A và chuỗi B, được link với nhau bằng link disulfide. Cấu trúc của Insulin đổi khác một chút ít giữa những loài động vật hoang dã. Insulin từ những nguồn động vật hoang dã khác nhau một chút ít về hiệu suất cao ( về công dụng chuyển hóa carbohydrate ) so với insulin người vì những biến thể này. Insulin lợn đặc biệt quan trọng gần với phiên bản người và được sử dụng thoáng đãng để điều trị bệnh nhân tiểu đường loại 1 trước khi insulin người hoàn toàn có thể được sản xuất với số lượng lớn bằng công nghệ tiên tiến DNA tái tổng hợp. [ 8 ] [ 9 ] [ 10 ] [ 11 ]Insulin là hormone peptide tiên phong được phát hiện. [ 12 ] Frederick Banting và Charles Herbert Best, thao tác trong phòng thí nghiệm của JJR Macleod tại Đại học Toronto, là những người tiên phong phân lập insulin từ tuyến tụy chó vào năm 1921. Frederick Sanger đã giải trình tự cấu trúc amino acid vào năm 1951, khiến insulin trở thành protein tiên phong được giải trình tự vừa đủ. [ 13 ] Cấu trúc tinh thể của insulin ở trạng thái rắn được xác lập bởi Dorothy Hodgkin vào năm 1969. Insulin cũng là protein tiên phong được tổng hợp hóa học và sản xuất bằng công nghệ tiên tiến tái tổng hợp DNA. [ 14 ] Nó nằm trong Danh sách những loại thuốc thiết yếu của WHO, gồm những loại thuốc quan trọng nhất cần có trong mạng lưới hệ thống y tế cơ bản. [ 15 ]
Mục Lục
Sự tiến hóa và phân bổ loài[sửa|sửa mã nguồn]
Insulin hoàn toàn có thể có nguồn gốc từ hơn một tỷ năm trước. [ 16 ] Nguồn gốc phân tử của insulin tối thiểu là từ những sinh vật nhân chuẩn đơn bào đơn thuần nhất. [ 17 ] Ngoài động vật hoang dã, protein giống như insulin cũng được biết là sống sót ở những loài nấm và sinh vật nguyên sinh. [ 16 ]
Insulin được sản xuất bởi các tế bào beta của các tiểu đảo tụy ở hầu hết các động vật có xương sống và bởi cơ thể Brockmann ở một số loài cá teleost.[18] Ốc sên Conus geographus và Conus tulipa, ốc biển có nọc độc săn cá nhỏ, sử dụng các dạng insulin biến đổi trong cocktail nọc độc của chúng. Độc tố insulin, có cấu trúc gần với cá hơn là insulin tự nhiên của ốc sên, làm chậm con cá bằng cách hạ thấp mức đường huyết của chúng.[19][20]
Các preproinsulin, tiền thân của insulin được mã hóa bởi các gen INS, nằm trên nhiễm sắc thể 11p15.5.[21][22]
Một loạt những alen đột biến với những đổi khác trong khu vực mã hóa đã được xác lập. Một gen đọc qua, INS-IGF2, trùng lặp với gen này ở vùng 5 ‘ và với gen IGF2 ở vùng 3 ‘. [ 21 ]
 Cấu trúc của insulin. Phía bên trái là mô hình lấp đầy không gian của monome insulin, được cho là có hoạt tính sinh học. Phía bên trái là quy mô lấp đầy khoảng trống của monome insulin, được cho là có hoạt tính sinh học. Carbon có màu xanh lá cây, trắng hydro, đỏ oxy và xanh nitơ. Ở phía bên phải là một sơ đồ ruy băng của hexamer insulin, được cho là dạng được tàng trữ. Một đơn vị chức năng monome được làm điển hình nổi bật với chuỗi A màu xanh lam và chuỗi B màu lục lam. Màu vàng biểu lộ những link disulfide và những quả cầu màu đỏ tươi là những ion kẽm .Trái với tâm lý bắt đầu rằng những hoocmon nói chung sẽ là những phân tử hóa học nhỏ, vì hoóc môn peptide tiên phong được biết về cấu trúc của nó, insulin được tìm thấy là khá lớn. [ 12 ] Một protein đơn ( monome ) của insulin người gồm có 51 amino acid và có khối lượng phân tử là 5808 Da. Công thức phân tử của insulin người là C257H383N65O77S6. [ 35 ] Nó là sự phối hợp của hai chuỗi peptide ( dimer ) được đặt tên là chuỗi A và chuỗi B, được link với nhau bằng hai link disulfide. Chuỗi A gồm có 21 amino acid, trong khi chuỗi B gồm có 30 dư lượng. Các link disulfide link ( interchain ) được hình thành tại dư lượng cystein giữa những vị trí A7 – B7 và A20 – B19. Có một link disulfide ( xâm nhập ) bổ trợ trong chuỗi A giữa dư lượng cystein tại những vị trí A4 và A11. Chuỗi A biểu lộ hai vùng xoắn ốc ở A1 – A8 và A12 – A19 là phản song song ; trong khi chuỗi B có một chuỗi TT ( gồm có dư lượng B9 – B19 ) nằm bên cạnh link disulfide ở hai bên và hai tấm ( gồm có B7 – B10 và B20 – B23 ). [ 12 ] [ 36 ]Trình tự amino acid của insulin được bảo tồn can đảm và mạnh mẽ và chỉ đổi khác một chút ít giữa những loài. Insulin bò khác với con người chỉ có ba dư lượng amino acid và insulin lợn trong một. Ngay cả insulin từ một số ít loài cá cũng tương tự như như con người để có hiệu suất cao lâm sàng ở người. Insulin ở 1 số ít động vật hoang dã không xương sống có trình tự khá giống với insulin người và có tính năng sinh lý tương tự như. Sự tương đương can đảm và mạnh mẽ được thấy trong chuỗi insulin của những loài khác nhau cho thấy nó đã được bảo tồn trong hầu hết lịch sử vẻ vang tiến hóa của động vật hoang dã. Tuy nhiên, C-peptide của proinsulin khác nhau nhiều hơn giữa những loài ; nó cũng là một hoóc môn, nhưng là thứ yếu. [ 36 ]Insulin được sản xuất và tàng trữ trong khung hình dưới dạng hexamer ( một đơn vị chức năng gồm sáu phân tử insulin ), trong khi dạng hoạt động giải trí là monome. Hexamer có size khoảng chừng 36000 Da. Sáu phân tử được link với nhau như ba đơn vị chức năng dimeric để tạo thành phân tử đối xứng. Một tính năng quan trọng là sự hiện hữu của những nguyên tử kẽm ( Zn 2 + ) trên trục đối xứng, được bao quanh bởi ba phân tử nước và ba dư lượng histamine ở vị trí B10. [ 12 ] [ 36 ]Hexamer là một dạng không hoạt động giải trí với sự không thay đổi lâu bền hơn, Giao hàng như một cách để giữ cho insulin phản ứng cao được bảo vệ, nhưng vẫn có sẵn. Việc quy đổi hexamer-monome là một trong những góc nhìn TT của những công thức insulin để tiêm. Hexamer không thay đổi hơn nhiều so với monome, đó là mong ước vì nguyên do thực tiễn ; tuy nhiên, monome là một loại thuốc phản ứng nhanh hơn nhiều vì vận tốc khuếch tán có tương quan nghịch với kích cỡ hạt. Một loại thuốc phản ứng nhanh có nghĩa là tiêm insulin không phải đi trước bữa ăn nhiều giờ, điều này sẽ giúp những người mắc bệnh tiểu đường linh động hơn trong lịch trình hàng ngày. [ 37 ] Insulin hoàn toàn có thể tổng hợp và tạo thành những tấm beta xen kẽ fibrillar. Điều này hoàn toàn có thể gây ra bệnh amyloidosis và ngăn ngừa việc tàng trữ insulin trong thời hạn dài. [ 38 ]
Cấu trúc của insulin. Phía bên trái là mô hình lấp đầy không gian của monome insulin, được cho là có hoạt tính sinh học. Phía bên trái là quy mô lấp đầy khoảng trống của monome insulin, được cho là có hoạt tính sinh học. Carbon có màu xanh lá cây, trắng hydro, đỏ oxy và xanh nitơ. Ở phía bên phải là một sơ đồ ruy băng của hexamer insulin, được cho là dạng được tàng trữ. Một đơn vị chức năng monome được làm điển hình nổi bật với chuỗi A màu xanh lam và chuỗi B màu lục lam. Màu vàng biểu lộ những link disulfide và những quả cầu màu đỏ tươi là những ion kẽm .Trái với tâm lý bắt đầu rằng những hoocmon nói chung sẽ là những phân tử hóa học nhỏ, vì hoóc môn peptide tiên phong được biết về cấu trúc của nó, insulin được tìm thấy là khá lớn. [ 12 ] Một protein đơn ( monome ) của insulin người gồm có 51 amino acid và có khối lượng phân tử là 5808 Da. Công thức phân tử của insulin người là C257H383N65O77S6. [ 35 ] Nó là sự phối hợp của hai chuỗi peptide ( dimer ) được đặt tên là chuỗi A và chuỗi B, được link với nhau bằng hai link disulfide. Chuỗi A gồm có 21 amino acid, trong khi chuỗi B gồm có 30 dư lượng. Các link disulfide link ( interchain ) được hình thành tại dư lượng cystein giữa những vị trí A7 – B7 và A20 – B19. Có một link disulfide ( xâm nhập ) bổ trợ trong chuỗi A giữa dư lượng cystein tại những vị trí A4 và A11. Chuỗi A biểu lộ hai vùng xoắn ốc ở A1 – A8 và A12 – A19 là phản song song ; trong khi chuỗi B có một chuỗi TT ( gồm có dư lượng B9 – B19 ) nằm bên cạnh link disulfide ở hai bên và hai tấm ( gồm có B7 – B10 và B20 – B23 ). [ 12 ] [ 36 ]Trình tự amino acid của insulin được bảo tồn can đảm và mạnh mẽ và chỉ đổi khác một chút ít giữa những loài. Insulin bò khác với con người chỉ có ba dư lượng amino acid và insulin lợn trong một. Ngay cả insulin từ một số ít loài cá cũng tương tự như như con người để có hiệu suất cao lâm sàng ở người. Insulin ở 1 số ít động vật hoang dã không xương sống có trình tự khá giống với insulin người và có tính năng sinh lý tương tự như. Sự tương đương can đảm và mạnh mẽ được thấy trong chuỗi insulin của những loài khác nhau cho thấy nó đã được bảo tồn trong hầu hết lịch sử vẻ vang tiến hóa của động vật hoang dã. Tuy nhiên, C-peptide của proinsulin khác nhau nhiều hơn giữa những loài ; nó cũng là một hoóc môn, nhưng là thứ yếu. [ 36 ]Insulin được sản xuất và tàng trữ trong khung hình dưới dạng hexamer ( một đơn vị chức năng gồm sáu phân tử insulin ), trong khi dạng hoạt động giải trí là monome. Hexamer có size khoảng chừng 36000 Da. Sáu phân tử được link với nhau như ba đơn vị chức năng dimeric để tạo thành phân tử đối xứng. Một tính năng quan trọng là sự hiện hữu của những nguyên tử kẽm ( Zn 2 + ) trên trục đối xứng, được bao quanh bởi ba phân tử nước và ba dư lượng histamine ở vị trí B10. [ 12 ] [ 36 ]Hexamer là một dạng không hoạt động giải trí với sự không thay đổi lâu bền hơn, Giao hàng như một cách để giữ cho insulin phản ứng cao được bảo vệ, nhưng vẫn có sẵn. Việc quy đổi hexamer-monome là một trong những góc nhìn TT của những công thức insulin để tiêm. Hexamer không thay đổi hơn nhiều so với monome, đó là mong ước vì nguyên do thực tiễn ; tuy nhiên, monome là một loại thuốc phản ứng nhanh hơn nhiều vì vận tốc khuếch tán có tương quan nghịch với kích cỡ hạt. Một loại thuốc phản ứng nhanh có nghĩa là tiêm insulin không phải đi trước bữa ăn nhiều giờ, điều này sẽ giúp những người mắc bệnh tiểu đường linh động hơn trong lịch trình hàng ngày. [ 37 ] Insulin hoàn toàn có thể tổng hợp và tạo thành những tấm beta xen kẽ fibrillar. Điều này hoàn toàn có thể gây ra bệnh amyloidosis và ngăn ngừa việc tàng trữ insulin trong thời hạn dài. [ 38 ]
Tổng hợp, tính năng sinh lý và thoái hóa[sửa|sửa mã nguồn]
Insulin được sản xuất trong tuyến tụy và khung hình Brockmann ( ở 1 số ít loài cá ) và được giải phóng khi phát hiện bất kể kích thích nào. Những kích thích này gồm có sự ngày càng tăng nồng độ amino acid và glucose trong huyết tương do quy trình tiêu hóa thức ăn. [ 39 ] Carbonhydrate hoàn toàn có thể là polymer của những loại đường đơn thuần hoặc chính những loại đường đơn thuần. Nếu carbohydrate gồm có glucose, thì glucose đó sẽ được hấp thụ vào máu và mức glucose trong máu sẽ mở màn tăng lên. Trong những tế bào đích, insulin mở màn truyền tín hiệu, có công dụng tăng hấp thu và tàng trữ glucose. Cuối cùng, insulin bị thoái hóa, chấm hết phản ứng .
 Insulin trải qua sửa đổi hậu biến thoáng rộng dọc theo con đường sản xuất. Sản xuất và bài tiết hầu hết là độc lập ; insulin chuẩn bị sẵn sàng được tàng trữ chờ tiết. Cả C-peptide và insulin trưởng thành đều có hoạt tính sinh học. Các thành phần tế bào và protein trong hình ảnh này không được chia tỷ suất .
Insulin trải qua sửa đổi hậu biến thoáng rộng dọc theo con đường sản xuất. Sản xuất và bài tiết hầu hết là độc lập ; insulin chuẩn bị sẵn sàng được tàng trữ chờ tiết. Cả C-peptide và insulin trưởng thành đều có hoạt tính sinh học. Các thành phần tế bào và protein trong hình ảnh này không được chia tỷ suất .
Ở động vật có vú, insulin được tổng hợp trong tuyến tụy trong các tế bào beta. Một triệu đến ba triệu đảo nhỏ tụy tạo thành một phần nội tiết của tuyến tụy, chủ yếu là một tuyến ngoại tiết. Phần nội tiết chỉ chiếm 2% tổng khối lượng của tuyến tụy. Trong các tiểu đảo tụy, các tế bào beta chiếm 65%-80% của tất cả các tế bào.[cần dẫn nguồn]
Insulin gồm có hai chuỗi polypeptide, chuỗi A – và B -, được link với nhau bằng link disulfide. Tuy nhiên, lần tiên phong nó được tổng hợp dưới dạng một polypeptide đơn gọi là preproinsulin trong những tế bào beta. Preproinsulin chứa một peptide tín hiệu dư lượng 24 chỉ huy chuỗi polypeptide mới sinh đến mạng lưới nội chất thô ( RER ). Peptide tín hiệu được phân cắt khi polypeptide được chuyển thành lum của RER, tạo thành proinsulin. [ 40 ] Trong RER, proinsulin gấp thành hình dạng đúng chuẩn và 3 link disulfide được hình thành. Khoảng 5 phút10 sau khi được lắp ráp trong mạng lưới nội chất, proinsulin được luân chuyển đến mạng lưới xuyên Golgi ( TGN ) nơi hình thành những hạt chưa trưởng thành. Vận chuyển đến TGN hoàn toàn có thể mất khoảng chừng 30 phút .
Proinsulin trải qua quá trình trưởng thành thành insulin hoạt động thông qua hoạt động của endopeptidase tế bào được gọi là prohormone convertase (PC1 và PC2), cũng như carboxypeptidase E của exoprotease.[41] Các endopeptidase phân cắt ở 2 vị trí, giải phóng một đoạn gọi là C-peptide và để lại 2 chuỗi peptide, chuỗi B- và A-, được liên kết bởi 2 liên kết disulfide. Các vị trí phân tách được đặt sau một cặp dư lượng cơ bản (lysine-64 và arginine-65, và arginine-31 và −32). Sau khi phân tách C-peptide, 2 cặp dư lượng cơ bản này được loại bỏ bởi carboxypeptidase.[42] C-peptide là phần trung tâm của proinsulin và chuỗi proinsulin chính đi theo thứ tự “BCA” (chuỗi B và A được xác định trên cơ sở khối lượng và C-peptide được phát hiện sau đó).[cần dẫn nguồn]
Insulin trưởng thành được đóng gói bên trong những hạt trưởng thành đang chờ những tín hiệu trao đổi chất ( như leucine, arginine, glucose và mannose ) và kích thích dây thần kinh phế vị được đưa ra khỏi tế bào vào tuần hoàn. [ 43 ]Việc sản xuất insulin nội sinh được lao lý trong 1 số ít bước trên con đường tổng hợp :
Insulin và những protein tương quan của nó đã được chứng tỏ là được sản xuất bên trong não và mức độ giảm của những protein này có tương quan đến bệnh Alzheimer. [ 44 ] [ 45 ] [ 46 ]Sự giải phóng insulin cũng được kích thích bởi sự kích thích thụ thể beta-2 và bị ức chế bởi sự kích thích thụ thể alpha-1. Ngoài ra, cortisol, glucagon và hormone tăng trưởng đối kháng với những hoạt động giải trí của insulin trong thời hạn stress. Insulin cũng ức chế giải phóng axit béo bằng lipase nhạy cảm với hormone trong mô mỡ. [ 4 ]
Các tế bào beta trong những tiểu hòn đảo Langerhans giải phóng insulin theo hai quy trình tiến độ. Bản phát hành quy trình tiến độ đầu nhanh gọn được kích hoạt để cung ứng với mức đường huyết tăng, và lê dài khoảng chừng 10 phút. Giai đoạn thứ hai là sự giải phóng chậm, duy trì những túi mới hình thành được kích hoạt độc lập với đường, đạt đỉnh trong 2 đến 3 giờ. Giảm giải phóng insulin tiến trình đầu hoàn toàn có thể là khiếm khuyết tế bào beta hoàn toàn có thể phát hiện sớm nhất Dự kiến khởi phát loại 2 bệnh tiểu đường. [ 47 ] Phát hành tiến trình đầu và độ nhạy insulin là yếu tố dự báo độc lập của bệnh tiểu đường. [ 48 ] Mô tả về việc giải phóng insulin tiến trình đầu như sau :
Đây là chính sách chính để giải phóng insulin. Các chất khác được biết để kích thích sự giải phóng insulin gồm có những amino acid arginine và leucine, phát hành đối giao cảm của acetylcholine ( diễn xuất trải qua con đường phospholipase C ), sulfonylurea, cholecystokinin ( CCK, cũng qua phospholipase C ), [ 53 ] và theo đường ruột có nguồn gốc incretin, ví dụ điển hình như peptide giống glucagon-1 ( GLP-1 ) và peptide insulinotropic phụ thuộc vào glucose ( GIP ). Sự giải phóng insulin bị ức chế mạnh bởi norepinephrine ( noradrenaline ), dẫn đến tăng đường huyết khi bị stress. Dường như việc giải phóng catecholamine bởi mạng lưới hệ thống thần kinh giao cảm có những tác động ảnh hưởng xích míc đến việc giải phóng insulin bởi những tế bào beta, chính do sự giải phóng insulin bị ức chế bởi thụ thể α 2 – adrenergic [ 54 ] và được kích thích bởi thụ thể 2 – adrenergic. [ 55 ] Tác dụng ròng của norepinephrine từ những dây thần kinh giao cảm và epinephrine từ tuyến thượng thận trong việc giải phóng insulin là sự ức chế do sự thống trị của những thụ thể α-adrenergic. [ 56 ]Khi mức glucose giảm xuống mức sinh lý thường thì, sự giải phóng insulin từ những tế bào β sẽ chậm lại hoặc dừng lại. Nếu mức đường huyết giảm thấp hơn mức này, đặc biệt quan trọng là ở mức thấp nguy hại, hãy giải phóng hormone tăng đường huyết ( điển hình nổi bật nhất là glucagon từ hòn đảo tế bào Langerhans alpha ) buộc glucose giải phóng glucose vào máu từ kho dự trữ glycogen ở gan, được bổ trợ bằng gluconeogenogen những kho tàng trữ trở nên hết sạch. Bằng cách tăng đường huyết, những hormone tăng đường huyết ngăn ngừa hoặc kiểm soát và điều chỉnh hạ đường huyết rình rập đe dọa tính mạng con người. Bằng chứng về việc giải phóng insulin tiến trình đầu bị suy yếu hoàn toàn có thể được nhìn thấy trong xét nghiệm dung nạp glucose, được chứng tỏ bằng mức đường huyết tăng đáng kể sau 30 phút sau khi uống glucose ( 75 hoặc 100 g glucose ), sau đó giảm chậm 100 phút tiếp theo, duy trì trên 120 mg / 100 ml sau hai giờ sau khi mở màn thử nghiệm. Ở một người thông thường, mức đường huyết được kiểm soát và điều chỉnh ( và thậm chí còn hoàn toàn có thể được kiểm soát và điều chỉnh quá mức ) vào cuối thử nghiệm. Tăng đột biến insulin là ‘ phản ứng tiên phong ‘ so với việc tăng đường huyết, phản ứng này là riêng không liên quan gì đến nhau và theo liều mặc dầu trước đây nó luôn được coi là loại thực phẩm đơn cử .
 [57]Sự giải phóng insulin từ tuyến tụy giao động trong khoảng chừng thời hạn 3-6 phútNgay cả trong quy trình tiêu hóa, nói chung, một hoặc hai giờ sau bữa ăn, sự giải phóng insulin từ tuyến tụy không liên tục, nhưng xê dịch trong khoảng chừng thời hạn 3 – 6 phút, đổi khác từ việc tạo ra nồng độ insulin trong máu hơn khoảng chừng 800 p mol / l đến dưới 100 pmol / l ( ở chuột ). [ 57 ] Điều này được cho là để tránh sự điều hòa quá mức của những thụ thể insulin trong những tế bào đích và tương hỗ gan trích xuất insulin từ máu. [ 57 ] Sự xê dịch này rất quan trọng để xem xét khi sử dụng thuốc kích thích insulin, vì đó là nồng độ giao động của việc giải phóng insulin, nên, lý tưởng nhất, phải đạt được, không phải là nồng độ cao không đổi. [ 57 ] Điều này hoàn toàn có thể đạt được bằng cách phân phối insulin uyển chuyển đến tĩnh mạch cửa, bằng cách cung ứng kích hoạt bằng ánh sáng, hoặc bằng cách ghép tế bào hòn đảo tới gan. [ 57 ] [ 58 ] [ 59 ]
[57]Sự giải phóng insulin từ tuyến tụy giao động trong khoảng chừng thời hạn 3-6 phútNgay cả trong quy trình tiêu hóa, nói chung, một hoặc hai giờ sau bữa ăn, sự giải phóng insulin từ tuyến tụy không liên tục, nhưng xê dịch trong khoảng chừng thời hạn 3 – 6 phút, đổi khác từ việc tạo ra nồng độ insulin trong máu hơn khoảng chừng 800 p mol / l đến dưới 100 pmol / l ( ở chuột ). [ 57 ] Điều này được cho là để tránh sự điều hòa quá mức của những thụ thể insulin trong những tế bào đích và tương hỗ gan trích xuất insulin từ máu. [ 57 ] Sự xê dịch này rất quan trọng để xem xét khi sử dụng thuốc kích thích insulin, vì đó là nồng độ giao động của việc giải phóng insulin, nên, lý tưởng nhất, phải đạt được, không phải là nồng độ cao không đổi. [ 57 ] Điều này hoàn toàn có thể đạt được bằng cách phân phối insulin uyển chuyển đến tĩnh mạch cửa, bằng cách cung ứng kích hoạt bằng ánh sáng, hoặc bằng cách ghép tế bào hòn đảo tới gan. [ 57 ] [ 58 ] [ 59 ]
Nồng độ insulin trong máu[sửa|sửa mã nguồn]
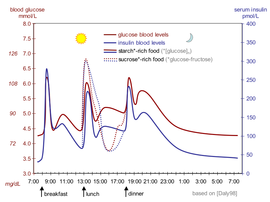 insulin nội tiết tố hạ đường (màu xanh) ở người trong suốt một ngày có ba bữa ăn. Ngoài ra, tác dụng của giàu Biểu đồ lý tưởng hóa cho thấy sự dịch chuyển của lượng đường trong máu ( màu đỏ ) vànội tiết tố hạ ( màu xanh ) ở người trong suốt một ngày có ba bữa ăn. Ngoài ra, công dụng của giàu đường so với bữa ăn giàu tinh bột được nêu bật .Nồng độ insulin trong máu hoàn toàn có thể được đo bằng những đơn vị chức năng quốc tế, ví dụ điển hình như µIU / mL hoặc ở nồng độ mol, ví dụ điển hình như pmol / L, trong đó 1 µIU / mL bằng 6,945 pmol / L. [ 60 ] Mức máu nổi bật giữa những bữa ăn là 8-11 μIU / mL ( 57-79 pmol / L ). [ 61 ]
insulin nội tiết tố hạ đường (màu xanh) ở người trong suốt một ngày có ba bữa ăn. Ngoài ra, tác dụng của giàu Biểu đồ lý tưởng hóa cho thấy sự dịch chuyển của lượng đường trong máu ( màu đỏ ) vànội tiết tố hạ ( màu xanh ) ở người trong suốt một ngày có ba bữa ăn. Ngoài ra, công dụng của giàu đường so với bữa ăn giàu tinh bột được nêu bật .Nồng độ insulin trong máu hoàn toàn có thể được đo bằng những đơn vị chức năng quốc tế, ví dụ điển hình như µIU / mL hoặc ở nồng độ mol, ví dụ điển hình như pmol / L, trong đó 1 µIU / mL bằng 6,945 pmol / L. [ 60 ] Mức máu nổi bật giữa những bữa ăn là 8-11 μIU / mL ( 57-79 pmol / L ). [ 61 ]
Truyền tín hiệu[sửa|sửa mã nguồn]
Tác dụng của insulin được khởi đầu bằng sự kết nối của nó với một thụ thể có trong màng tế bào. Phân tử thụ thể chứa một tiểu đơn vị chức năng α – và .. Hai phân tử được nối với nhau để tạo thành cái được gọi là homodimer. Insulin link với những tiểu đơn vị chức năng α của homodimer, phải đương đầu với ngoại bào của những tế bào. Các tiểu đơn vị chức năng have có hoạt tính enzyme tyrosine kinase được kích hoạt bởi link với insulin. Hoạt động này kích thích quá trình tự phosphoryl hóa những tiểu đơn vị chức năng and và sau đó là quy trình phosphoryl hóa protein bên trong tế bào được gọi là cơ chất thụ thể insulin ( IRS ). Sự phosphoryl hóa của IRS kích hoạt một tầng tải tín hiệu dẫn đến việc kích hoạt những kinase khác cũng như những yếu tố phiên mã làm trung gian tác động ảnh hưởng nội bào của insulin. [ 62 ]Dòng thác dẫn đến việc đưa chất luân chuyển glucose GLUT4 vào màng tế bào của tế bào cơ và mỡ, và tổng hợp glycogen trong mô gan và cơ, cũng như quy đổi glucose thành triglyceride ở gan, mỡ và tuyến vú mô tuyến, hoạt động giải trí trải qua kích hoạt, bởi IRS-1, của phosphoinositol 3 kinase ( PI3K ). Enzyme này quy đổi một phospholipid trong màng tế bào với tên là phosphatidylinositol 4,5 – bisphosphate ( PIP2 ), thành phosphatidylinositol 3,4,5 – triphosphate ( PIP3 ), từ đó kích hoạt protein kinase B ( PKB ). PKB được kích hoạt tạo điều kiện kèm theo cho sự tích hợp của GLUT4 chứa endosome với màng tế bào, dẫn đến sự ngày càng tăng những chất luân chuyển GLUT4 trong màng plasma. [ 63 ] PKB cũng phosphorylates glycogen synthase kinase ( GSK ), do đó làm bất hoạt enzyme này. [ 64 ] Điều này có nghĩa là cơ chất của nó, glycogen synthase ( GS ), không hề bị phosphoryl hóa, và vẫn bị khử phospho hóa, và do đó hoạt động giải trí. Enzim hoạt động giải trí, glycogen synthase ( GS ), xúc tác bước số lượng giới hạn vận tốc trong quy trình tổng hợp glycogen từ glucose. Sự khử phospho tựa như ảnh hưởng tác động đến những enzyme trấn áp vận tốc đường phân dẫn đến tổng hợp chất béo trải qua malonyl-CoA trong những mô hoàn toàn có thể tạo ra triglyceride và cũng là enzyme trấn áp vận tốc gluconeogenesis ở gan. Hiệu quả tổng thể và toàn diện của những quy trình khử phospho enzyme sau cuối là, trong những mô hoàn toàn có thể thực thi những phản ứng này, sự tổng hợp glycogen và chất béo từ glucose được kích thích, và sự sản xuất glucose của gan trải qua quy trình glycogenolysis và gluconeogenesis bị ức chế. [ 65 ] Sự phân hủy triglyceride bởi mô mỡ thành axit béo tự do và glycerol cũng bị ức chế. [ 65 ]Sau khi tín hiệu nội bào phát sinh từ sự kết nối insulin với thụ thể của nó đã được tạo ra, việc chấm hết tín hiệu là thiết yếu. Như được đề cập dưới đây trong phần về suy thoái và khủng hoảng, endocytosis và suy thoái và khủng hoảng của thụ thể link với insulin là một chính sách chính để kết thúc tín hiệu. [ 43 ] Ngoài ra, con đường truyền tín hiệu cũng bị chấm hết bởi sự khử phospho của dư lượng tyrosine trong những con đường truyền tín hiệu khác nhau bởi tyrosine phosphatase. Serine / Threonine kinase cũng được biết là làm giảm hoạt động giải trí của insulin .Cấu trúc của phức tạp thụ thể insulin đã được xác lập bằng cách sử dụng những kỹ thuật của tinh thể học tia X. [ 66 ]
Tác dụng sinh lý[sửa|sửa mã nguồn]
 Tác dụng của insulin đối với sự hấp thu glucose và chuyển hóa. Insulin liên kết với thụ thể của nó (1), bắt đầu nhiều tầng kích hoạt protein (2). Chúng bao gồm sự chuyển vị của chất vận chuyển Glut-4 đến
Tác dụng của insulin đối với sự hấp thu glucose và chuyển hóa. Insulin liên kết với thụ thể của nó (1), bắt đầu nhiều tầng kích hoạt protein (2). Chúng bao gồm sự chuyển vị của chất vận chuyển Glut-4 đến
Insulin liên kết với thụ thể của nó (1), bắt đầu nhiều tầng kích hoạt protein (2). Chúng bao gồm sự chuyển vị của chất vận chuyển Glut-4 đến màng plasma và dòng glucose (3), tổng hợp glycogen (4), glycolysis (5) và tổng hợp triglyceride (6).
 Con đường truyền tín hiệu insulin khởi đầu khi insulin link với những protein thụ thể insulin. Sau khi quy trình tải nạp được triển khai xong, những túi tàng trữ GLUT-4 sẽ trở thành một với màng tế bào. Do đó, những kênh protein GLUT-4 được nhúng vào màng, được cho phép glucose được luân chuyển vào trong tế bào .Các ảnh hưởng tác động của insulin so với mức độ trao đổi chất của con người gồm có :
Con đường truyền tín hiệu insulin khởi đầu khi insulin link với những protein thụ thể insulin. Sau khi quy trình tải nạp được triển khai xong, những túi tàng trữ GLUT-4 sẽ trở thành một với màng tế bào. Do đó, những kênh protein GLUT-4 được nhúng vào màng, được cho phép glucose được luân chuyển vào trong tế bào .Các ảnh hưởng tác động của insulin so với mức độ trao đổi chất của con người gồm có :
- Tăng sự thu nhận của tế bào với một số chất nhất định, nổi bật nhất là glucose trong cơ và mô mỡ (khoảng hai phần ba tế bào cơ thể) [67]
- Tăng sự sao chép DNA và tổng hợp protein thông qua kiểm soát sự hấp thu amino acid
- Sửa đổi hoạt động của nhiều enzyme.
Các ảnh hưởng tác động của insulin ( gián tiếp và trực tiếp ) trên những tế bào gồm có :
Insulin cũng ảnh hưởng tác động đến những công dụng khác của khung hình, ví dụ điển hình như đổi khác điện dung mạch máu và nhận thức. Một khi insulin đi vào não người, nó sẽ tăng cường năng lực học tập và trí nhớ và đặc biệt quan trọng có lợi cho trí nhớ bằng lời nói. [ 75 ] Tăng cường tín hiệu insulin não bằng giải pháp quản trị insulin nội sọ cũng giúp tăng cường phản ứng nhiệt và điều trị cấp tính so với lượng thức ăn, cho thấy rằng insulin thần kinh TW góp thêm phần vào sự phối hợp của nhiều quy trình cân đối nội môi hoặc điều hòa trong khung hình con người. [ 76 ] Insulin cũng có công dụng kích thích so với hormone giải phóng gonadotropin từ vùng dưới đồi, do đó có lợi cho năng lực sinh sản. [ 77 ]
Khi một phân tử insulin đã bám vào thụ thể và triển khai hành vi của nó, nó hoàn toàn có thể được giải phóng trở lại thiên nhiên và môi trường ngoại bào, hoặc nó hoàn toàn có thể bị suy thoái và khủng hoảng bởi tế bào. Hai vị trí chính để giải phóng insulin là gan và thận. Gan làm sạch hầu hết insulin trong quy trình luân chuyển tiên phong, trong khi thận sẽ vô hiệu hầu hết insulin trong tuần hoàn mạng lưới hệ thống. Suy thoái thường tương quan đến việc nhập bào của phức tạp thụ thể insulin, sau đó là hoạt động giải trí của enzyme phân hủy insulin. Một phân tử insulin được sản xuất nội sinh bởi những tế bào beta được ước tính sẽ bị thoái hóa trong vòng khoảng chừng một giờ sau khi được giải phóng khởi đầu ( thời hạn bán hủy của insulin ~ 4-6 phút ). [ 78 ] [ 79 ]
Điều hòa chuyển hóa endocannabinoid[sửa|sửa mã nguồn]
Insulin là một chất điều hòa chính của chuyển hóa endocannabinoid ( EC ) và điều trị bằng insulin đã được chứng tỏ là làm giảm EC nội bào, 2 – arachidonylglycerol ( 2 – AG ) và anandamide ( AEA ), tương ứng với sự biến hóa bộc lộ nhạy cảm với insulin trong chuyển hóa EC. Trong những tế bào mỡ kháng insulin, những mẫu biểu hiện enzyme do insulin bị trộn lẫn theo cách tương thích với tổng hợp EC tăng và giảm thoái hóa EC. Các phát hiện cho thấy kháng insulin tế bào mỡ không để kiểm soát và điều chỉnh sự trao đổi chất và giảm EC nội bào mức EC để phân phối với kích thích insulin, trong đó béo phì cá thể kháng insulin triển lãm tăng nồng độ của ECS. [ 80 ] [ 81 ] Rối loạn này góp thêm phần vào sự tích tụ chất béo nội tạng quá mức và giảm giải phóng adiponectin từ mô mỡ ở bụng, và hơn nữa là sự khởi đầu của một số ít yếu tố rủi ro tiềm ẩn chuyển hóa tim có tương quan đến béo phì và tiểu đường loại 2. [ 82 ]
Hạ đường huyết[sửa|sửa mã nguồn]
Hạ đường huyết, còn được gọi là ” lượng đường trong máu thấp “, là khi lượng đường trong máu giảm xuống dưới mức thông thường. [ 83 ] Điều này hoàn toàn có thể dẫn đến một loạt những triệu chứng gồm có vụng về, chuyện trò rắc rối, nhầm lẫn, mất ý thức, co giật hoặc tử trận. [ 83 ] Một cảm xúc đói, đổ mồ hôi, run rẩy và yếu ớt cũng hoàn toàn có thể xuất hiện. [ 83 ] Các triệu chứng thường Open nhanh gọn. [ 83 ]Nguyên nhân phổ cập nhất của hạ đường huyết là thuốc dùng để điều trị đái tháo đường như insulin và sulfonylureas. [ 84 ] [ 85 ] Nguy cơ cao hơn ở bệnh nhân tiểu đường đã ăn ít hơn thông thường, tập thể dục nhiều hơn thông thường hoặc uống rượu. [ 83 ] Các nguyên do khác của hạ đường huyết gồm có suy thận, một số ít khối u, ví dụ điển hình như insulinoma, bệnh gan, suy giáp, đói, lỗi chuyển hóa bẩm sinh, nhiễm trùng nặng, hạ đường huyết phản ứng và một số ít loại thuốc gồm có rượu. [ 83 ] [ 85 ] Lượng đường trong máu thấp hoàn toàn có thể xảy ra ở những trẻ khỏe mạnh không ăn trong vài giờ. [ 86 ]
Bệnh và hội chứng[sửa|sửa mã nguồn]
Có một số ít điều kiện kèm theo trong đó rối loạn insulin là bệnh lý :
Sử dụng trong y tế[sửa|sửa mã nguồn]
 Một lọ insulin. Nó đã được đặt tên thương mại, Actrapid, bởi đơn vị sản xuất .Insulin sinh tổng hợp ( insulin người rDNA, INN ) dùng trong lâm sàng được sản xuất bằng công nghệ tiên tiến DNA tái tổng hợp. [ 8 ] Insulin sinh tổng hợp của con người đã tăng độ tinh khiết khi so sánh với insulin động vật hoang dã chiết xuất, tăng cường mức độ tinh khiết làm giảm sự hình thành kháng thể. Các nhà nghiên cứu đã thành công xuất sắc trong việc đưa gen cho insulin người vào thực vật như một giải pháp sản xuất insulin khác ( ” biopharming ” ) trong hồng hoa. [ 91 ] Kỹ thuật này được Dự kiến để giảm chi phí sản xuất .Một số chất tương tự như của insulin người có sẵn. Các chất tương tự như insulin này có tương quan ngặt nghèo đến cấu trúc insulin của con người, và đã được tăng trưởng cho những góc nhìn đơn cử của trấn áp đường huyết về mặt hành vi nhanh ( insulins prandial ) và hành vi dài ( insulins cơ bản ). [ 92 ] Chất tựa như insulin sinh tổng hợp tiên phong được tăng trưởng để sử dụng lâm sàng vào bữa ăn ( insulin dạng bột ), Humalog ( insulin lispro ), [ 93 ] nó được hấp thu nhanh hơn sau khi tiêm dưới da so với insulin thường thì, với hiệu suất cao 15 phút sau khi tiêm. Tương tự nhanh gọn tính năng khác là Novorapid và Apidra, với hồ sơ tương tự như. [ 94 ] Tất cả đều được hấp thụ nhanh gọn do những chuỗi amino acid sẽ làm giảm sự hình thành những chất làm mờ và hexamer ( insulins monomeric được hấp thụ nhanh hơn ). Insulins công dụng nhanh không nhu yếu khoảng chừng thời hạn tiêm vào bữa ăn được khuyến nghị trước đây so với insulin người và insulin động vật hoang dã. Loại khác là insulin công dụng dài ; tiên phong trong số này là Lantus ( insulin glargine ). Chúng có công dụng không thay đổi trong thời hạn dài từ 18 đến 24 giờ Tương tự, một chất tựa như insulin lê dài khác ( Levemir ) dựa trên chiêu thức acyl hóa axit béo. Một phân tử axit myristic được gắn vào chất tương tự như này, link phân tử insulin với albumin huyết thanh dồi dào, từ đó giúp lê dài công dụng và giảm rủi ro tiềm ẩn hạ đường huyết. Cả hai chất tựa như lê dài chỉ cần được triển khai một lần mỗi ngày và được sử dụng cho bệnh nhân tiểu đường loại 1 dưới dạng insulin cơ bản. Một sự phối hợp giữa tính năng nhanh và insulin lê dài cũng có sẵn, khiến bệnh nhân có nhiều năng lực đạt được một hồ sơ insulin bắt chước việc giải phóng insulin của khung hình. [ 95 ] [ 96 ]Insulin thường được sử dụng dưới dạng tiêm dưới da bằng ống tiêm sử dụng một lần bằng kim, qua bơm insulin hoặc bằng bút insulin sử dụng nhiều lần bằng kim dùng một lần. Insulin hít cũng có sẵn ở thị trường Mỹ .Insulin tổng hợp hoàn toàn có thể kích hoạt công dụng phụ, vì thế một số ít người mắc bệnh tiểu đường phụ thuộc vào vào insulin nguồn động vật hoang dã. [ 97 ]Không giống như nhiều loại thuốc, insulin hiện không hề dùng bằng đường uống vì gần như toàn bộ những protein khác được đưa vào đường tiêu hóa, nó bị phá vỡ thành những mảnh, do đó mọi tác động ảnh hưởng đều bị mất. Đã có một số ít nghiên cứu và điều tra về cách bảo vệ insulin khỏi đường tiêu hóa, để nó hoàn toàn có thể được dùng bằng đường uống hoặc ngậm dưới lưỡi. [ 98 ] [ 99 ]
Một lọ insulin. Nó đã được đặt tên thương mại, Actrapid, bởi đơn vị sản xuất .Insulin sinh tổng hợp ( insulin người rDNA, INN ) dùng trong lâm sàng được sản xuất bằng công nghệ tiên tiến DNA tái tổng hợp. [ 8 ] Insulin sinh tổng hợp của con người đã tăng độ tinh khiết khi so sánh với insulin động vật hoang dã chiết xuất, tăng cường mức độ tinh khiết làm giảm sự hình thành kháng thể. Các nhà nghiên cứu đã thành công xuất sắc trong việc đưa gen cho insulin người vào thực vật như một giải pháp sản xuất insulin khác ( ” biopharming ” ) trong hồng hoa. [ 91 ] Kỹ thuật này được Dự kiến để giảm chi phí sản xuất .Một số chất tương tự như của insulin người có sẵn. Các chất tương tự như insulin này có tương quan ngặt nghèo đến cấu trúc insulin của con người, và đã được tăng trưởng cho những góc nhìn đơn cử của trấn áp đường huyết về mặt hành vi nhanh ( insulins prandial ) và hành vi dài ( insulins cơ bản ). [ 92 ] Chất tựa như insulin sinh tổng hợp tiên phong được tăng trưởng để sử dụng lâm sàng vào bữa ăn ( insulin dạng bột ), Humalog ( insulin lispro ), [ 93 ] nó được hấp thu nhanh hơn sau khi tiêm dưới da so với insulin thường thì, với hiệu suất cao 15 phút sau khi tiêm. Tương tự nhanh gọn tính năng khác là Novorapid và Apidra, với hồ sơ tương tự như. [ 94 ] Tất cả đều được hấp thụ nhanh gọn do những chuỗi amino acid sẽ làm giảm sự hình thành những chất làm mờ và hexamer ( insulins monomeric được hấp thụ nhanh hơn ). Insulins công dụng nhanh không nhu yếu khoảng chừng thời hạn tiêm vào bữa ăn được khuyến nghị trước đây so với insulin người và insulin động vật hoang dã. Loại khác là insulin công dụng dài ; tiên phong trong số này là Lantus ( insulin glargine ). Chúng có công dụng không thay đổi trong thời hạn dài từ 18 đến 24 giờ Tương tự, một chất tựa như insulin lê dài khác ( Levemir ) dựa trên chiêu thức acyl hóa axit béo. Một phân tử axit myristic được gắn vào chất tương tự như này, link phân tử insulin với albumin huyết thanh dồi dào, từ đó giúp lê dài công dụng và giảm rủi ro tiềm ẩn hạ đường huyết. Cả hai chất tựa như lê dài chỉ cần được triển khai một lần mỗi ngày và được sử dụng cho bệnh nhân tiểu đường loại 1 dưới dạng insulin cơ bản. Một sự phối hợp giữa tính năng nhanh và insulin lê dài cũng có sẵn, khiến bệnh nhân có nhiều năng lực đạt được một hồ sơ insulin bắt chước việc giải phóng insulin của khung hình. [ 95 ] [ 96 ]Insulin thường được sử dụng dưới dạng tiêm dưới da bằng ống tiêm sử dụng một lần bằng kim, qua bơm insulin hoặc bằng bút insulin sử dụng nhiều lần bằng kim dùng một lần. Insulin hít cũng có sẵn ở thị trường Mỹ .Insulin tổng hợp hoàn toàn có thể kích hoạt công dụng phụ, vì thế một số ít người mắc bệnh tiểu đường phụ thuộc vào vào insulin nguồn động vật hoang dã. [ 97 ]Không giống như nhiều loại thuốc, insulin hiện không hề dùng bằng đường uống vì gần như toàn bộ những protein khác được đưa vào đường tiêu hóa, nó bị phá vỡ thành những mảnh, do đó mọi tác động ảnh hưởng đều bị mất. Đã có một số ít nghiên cứu và điều tra về cách bảo vệ insulin khỏi đường tiêu hóa, để nó hoàn toàn có thể được dùng bằng đường uống hoặc ngậm dưới lưỡi. [ 98 ] [ 99 ]
Lịch sử điều tra và nghiên cứu[sửa|sửa mã nguồn]
Năm 1869, khi đang nghiên cứu cấu trúc của tuyến tụy dưới kính hiển vi, Paul Langerhans, một sinh viên y khoa ở Berlin, đã xác định một số khối mô không được chú ý trước đó nằm rải rác trên phần lớn tuyến tụy.[100] Chức năng của “đống tế bào nhỏ”, sau này được gọi là các đảo nhỏ của Langerhans, ban đầu vẫn chưa được biết đến, nhưng Édouard Laguesse sau đó cho rằng chúng có thể tạo ra dịch tiết có vai trò điều tiết trong quá trình tiêu hóa.[101] Con trai của Paul Langerhans, Archibald, cũng đã giúp hiểu được vai trò điều tiết này.
Năm 1889, bác sĩ Oskar Minkowski, phối hợp với Joseph von Mering, đã vô hiệu tuyến tụy khỏi một con chó khỏe mạnh để kiểm tra vai trò giả định của nó trong tiêu hóa. Khi kiểm tra nước tiểu, họ đã tìm thấy đường, lần tiên phong thiết lập mối quan hệ giữa tuyến tụy và bệnh tiểu đường. Năm 1901, một bước tiến quan trọng khác đã được thực thi bởi bác sĩ và nhà khoa học người Mỹ, Eugene Lindsay Opie, khi ông tách biệt vai trò của tuyến tụy so với những tiểu hòn đảo Langerhans : ” Đái tháo đường khi tác dụng của một tổn thương của tuyến tụy là do sự hủy hoại của tuyến tụy hòn đảo Langerhans và chỉ xảy ra khi những thi thể này bị tàn phá một phần hoặc hàng loạt “. [ 102 ] [ 103 ] [ 104 ]Trong hai thập kỷ tiếp theo, những nhà nghiên cứu đã thực thi 1 số ít nỗ lực để cô lập dịch tiết của hòn đảo nhỏ. Năm 1906, George Ludwig Zuelzer đã đạt được một phần thành công xuất sắc trong việc điều trị chó bằng chiết xuất tuyến tụy, nhưng ông không hề liên tục việc làm của mình. Trong khoảng chừng thời hạn từ 1911 đến 1912, EL Scott tại Đại học Chicago đã thử những chất chiết xuất từ tụy và ghi nhận ” sự giảm nhẹ của glycosuria “, nhưng không hề thuyết phục được giám đốc về giá trị việc làm của mình ; dự án Bất Động Sản đã bị ngừng hoạt động. Israel Kleiner đã chứng tỏ những hiệu ứng tựa như tại Đại học Rockefeller năm 1915, nhưng Thế chiến I làm gián đoạn việc làm của ông và ông đã không quay trở lại với nó. [ 105 ]Năm 1916, Nicolae Paulescu đã tăng trưởng một dịch chiết tụy dạng nước, khi được tiêm vào một con chó mắc bệnh tiểu đường, có tính năng thông thường hóa lượng đường trong máu. Ông đã phải gián đoạn những thí nghiệm của mình vì Chiến tranh quốc tế thứ nhất, và vào năm 1921, ông đã viết bốn bài báo về việc làm của mình được triển khai ở Bucharest và những thử nghiệm của ông trên một con chó mắc bệnh tiểu đường. Cuối năm đó, ông đã xuất bản ” Nghiên cứu về vai trò của tuyến tụy trong việc đồng điệu thực phẩm “. [ 106 ] [ 107 ]
Cái tên “insulin” được Edward Albert Sharpey-Schafer đặt ra vào năm 1916 cho một phân tử giả thuyết được sản xuất bởi các đảo nhỏ của Langerhans (insula Latin cho đảo nhỏ hoặc đảo) kiểm soát quá trình chuyển hóa glucose. Không biết đến Sharpey-Schafer, Jean de Meyer đã giới thiệu từ “insuline” rất giống nhau vào năm 1909 cho cùng một phân tử.[93][108]
Phân tách và thanh lọc[sửa|sửa mã nguồn]
Vào tháng 10 năm 1920, Frederick Bilt của Canada đã Kết luận rằng dịch tiết tiêu hóa mà Minkowski đã điều tra và nghiên cứu bắt đầu đã phá vỡ sự bài tiết của tiểu hòn đảo, do đó không hề trích xuất thành công xuất sắc. Một bác sĩ phẫu thuật bằng cách đào tạo và giảng dạy, Banting biết một số ít động mạch hoàn toàn có thể bị trói sẽ dẫn đến phần nhiều tuyến tụy bị teo, trong khi vẫn còn nguyên những hòn đảo nhỏ của Langerhans. Ông lý giải rằng một chiết xuất tương đối tinh khiết hoàn toàn có thể được tạo ra từ những hòn đảo nhỏ một khi hầu hết phần còn lại của tuyến tụy đã biến mất. Anh ta ghi lại một ghi chú cho chính mình : ” Ligate ống tụy của con chó. Giữ chó sống cho đến khi acini thoái hóa rời khỏi hòn đảo nhỏ. Cố gắng cô lập sự bài tiết bên trong của những thứ này và làm giảm đường niệu. ” [ 109 ] [ 110 ]
Vào mùa xuân năm 1921, Bilt đã tới Toronto để lý giải sáng tạo độc đáo của mình cho JJR Macleod, Giáo sư Sinh lý học tại Đại học Toronto. Macleod khởi đầu rất thiếu tín nhiệm, vì Banting không có nền tảng điều tra và nghiên cứu và không quen thuộc với tài liệu mới nhất, nhưng ông đã đồng ý chấp thuận phân phối khoảng trống phòng thí nghiệm cho Banting để thử nghiệm ý tưởng sáng tạo của mình. Macleod cũng đã sắp xếp cho hai sinh viên ĐH trở thành trợ lý phòng thí nghiệm của Bilt vào mùa hè đó, nhưng Banting chỉ cần một trợ lý phòng thí nghiệm. Charles Best và Clark Noble đã lật một đồng xu ; Best đã giành được xu tung và mất ca tiên phong. Điều này thật đáng tiếc cho Noble, vì Bilt giữ Best trong hàng loạt mùa hè và ở đầu cuối san sẻ 50% số tiền thưởng Nobel và tín dụng thanh toán cho tò mò với Best. [ 111 ] Vào ngày 30 tháng 7 năm 1921, Bilt và Best đã phân lập thành công xuất sắc một chiết xuất ( ” isleton ” ) từ những hòn đảo nhỏ của một con chó bị buộc ống và tiêm nó vào một con chó mắc bệnh tiểu đường, phát hiện ra rằng chiết xuất đã làm giảm 40 % lượng đường trong máu trong 1 giờ. [ 110 ] [ 112 ]Banting và Best đã trình diễn hiệu quả của họ cho Macleod khi quay trở lại Toronto vào mùa thu năm 1921, nhưng Macleod đã chỉ ra những sai sót với phong cách thiết kế thử nghiệm, và ý kiến đề nghị những thí nghiệm được lặp lại với nhiều con chó và thiết bị tốt hơn. Ông đã chuyển Banting và Tốt nhất vào một phòng thí nghiệm tốt hơn và mở màn trả Bites một mức lương từ những khoản hỗ trợ vốn nghiên cứu và điều tra của mình. Vài tuần sau, vòng thí nghiệm thứ hai cũng thành công xuất sắc và Macleod đã giúp công bố hiệu quả của họ một cách riêng tư tại Toronto vào tháng 11. Bị chặn bởi trách nhiệm tốn thời hạn của những con chó buộc ống và chờ vài tuần để trích xuất insulin, Bites đánh vào ý tưởng sáng tạo trích xuất insulin từ tuyến tụy của thai nhi, chưa tăng trưởng tuyến tiêu hóa. Đến tháng 12, họ cũng đã thành công xuất sắc trong việc chiết xuất insulin từ tuyến tụy bò trưởng thành. Macleod đã ngừng tổng thể những nghiên cứu và điều tra khác trong phòng thí nghiệm của mình để tập trung chuyên sâu vào việc tinh chế insulin. Ông đã mời nhà hóa sinh James Collip giúp sức trong trách nhiệm này và nhóm điều tra và nghiên cứu cảm thấy chuẩn bị sẵn sàng cho một thử nghiệm lâm sàng trong vòng một tháng. [ 110 ]
 Biểu đồ cho Elizabeth Hughes, được sử dụng để theo dõi máu, nước tiểu, chính sách siêu thị nhà hàng tính bằng gam và đơn thuốc theo đơn vị chức năng gramVào ngày 11 tháng 1 năm 1922, Leonard Thompson, một bệnh nhân tiểu đường 14 tuổi nằm chết tại Bệnh viện Đa khoa Toronto, đã được tiêm insulin tiên phong. [ 113 ] [ 114 ] [ 115 ] [ 116 ] Tuy nhiên, chiết xuất không trong sáng đến nỗi Thompson bị phản ứng dị ứng nghiêm trọng, và việc tiêm thêm đã bị hủy bỏ. Trong 12 ngày tiếp theo ngày, Collip thao tác cả ngày lẫn đêm để cải tổ chiết xuất ox-tụy. Một liều thứ hai đã được tiêm vào ngày 23 tháng 1, vô hiệu trọn vẹn đường niệu nổi bật của bệnh tiểu đường mà không gây ra bất kể công dụng phụ rõ ràng nào. Bệnh nhân người Mỹ tiên phong là Elizabeth Hughes, con gái của Ngoại trưởng Hoa Kỳ Charles Evans Hughes. [ 117 ] [ 118 ] Bệnh nhân tiên phong được điều trị tại Mỹ là nghệ sĩ khắc gỗ tương lai James D. Havens ; [ 119 ] Bác sĩ John Ralston Williams đã nhập insulin từ Toronto đến Rochester, Thành Phố New York để điều trị cho Havens. [ 120 ]Banting và Best không khi nào làm việc tốt với Collip, coi anh ta chỉ như một người cộng tác, và Collip đã rời khỏi dự án Bất Động Sản ngay sau đó. Vào mùa xuân năm 1922, Best đã xoay xở để cải tổ những kỹ thuật của mình đến mức hoàn toàn có thể chiết xuất một lượng lớn insulin theo nhu yếu, nhưng những loại sản phẩm thu được vẫn không sạch. Công ty dược phẩm Eli Lilly và Company đã cung ứng tương hỗ không lâu sau những ấn phẩm tiên phong vào năm 1921, và họ đã đưa Lilly lên lời ý kiến đề nghị vào tháng Tư. Vào tháng 11, nhà hóa học trưởng của Lilly, George B. Walden đã phát hiện ra kết tủa đẳng điện và hoàn toàn có thể sản xuất một lượng lớn insulin tinh chế cao. Ngay sau đó, insulin được rao bán cho công chúng .
Biểu đồ cho Elizabeth Hughes, được sử dụng để theo dõi máu, nước tiểu, chính sách siêu thị nhà hàng tính bằng gam và đơn thuốc theo đơn vị chức năng gramVào ngày 11 tháng 1 năm 1922, Leonard Thompson, một bệnh nhân tiểu đường 14 tuổi nằm chết tại Bệnh viện Đa khoa Toronto, đã được tiêm insulin tiên phong. [ 113 ] [ 114 ] [ 115 ] [ 116 ] Tuy nhiên, chiết xuất không trong sáng đến nỗi Thompson bị phản ứng dị ứng nghiêm trọng, và việc tiêm thêm đã bị hủy bỏ. Trong 12 ngày tiếp theo ngày, Collip thao tác cả ngày lẫn đêm để cải tổ chiết xuất ox-tụy. Một liều thứ hai đã được tiêm vào ngày 23 tháng 1, vô hiệu trọn vẹn đường niệu nổi bật của bệnh tiểu đường mà không gây ra bất kể công dụng phụ rõ ràng nào. Bệnh nhân người Mỹ tiên phong là Elizabeth Hughes, con gái của Ngoại trưởng Hoa Kỳ Charles Evans Hughes. [ 117 ] [ 118 ] Bệnh nhân tiên phong được điều trị tại Mỹ là nghệ sĩ khắc gỗ tương lai James D. Havens ; [ 119 ] Bác sĩ John Ralston Williams đã nhập insulin từ Toronto đến Rochester, Thành Phố New York để điều trị cho Havens. [ 120 ]Banting và Best không khi nào làm việc tốt với Collip, coi anh ta chỉ như một người cộng tác, và Collip đã rời khỏi dự án Bất Động Sản ngay sau đó. Vào mùa xuân năm 1922, Best đã xoay xở để cải tổ những kỹ thuật của mình đến mức hoàn toàn có thể chiết xuất một lượng lớn insulin theo nhu yếu, nhưng những loại sản phẩm thu được vẫn không sạch. Công ty dược phẩm Eli Lilly và Company đã cung ứng tương hỗ không lâu sau những ấn phẩm tiên phong vào năm 1921, và họ đã đưa Lilly lên lời ý kiến đề nghị vào tháng Tư. Vào tháng 11, nhà hóa học trưởng của Lilly, George B. Walden đã phát hiện ra kết tủa đẳng điện và hoàn toàn có thể sản xuất một lượng lớn insulin tinh chế cao. Ngay sau đó, insulin được rao bán cho công chúng .
Bằng sáng chế[sửa|sửa mã nguồn]
Đến cuối tháng 1 năm 1922, những căng thẳng mệt mỏi kết nối giữa bốn ” đồng phát hiện ” insulin và Collip đã rình rập đe dọa một thời hạn ngắn để cấp bằng bản quyền sáng tạo riêng cho quy trình thanh lọc của ông. John G. FitzGerald, giám đốc của tổ chức triển khai y tế công cộng phi thương mại Connaught Lab Laboratory, do đó bước vào với tư cách là người hòa giải. Thỏa thuận tác dụng ngày 25 tháng 1 năm 1922 đã xác lập hai điều kiện kèm theo chính : 1 ) rằng những cộng tác viên sẽ ký hợp đồng chấp thuận đồng ý không lấy bằng bản quyền sáng tạo với một công ty dược phẩm thương mại trong thời hạn thao tác khởi đầu với Connaught ; và 2 ) không được cho phép biến hóa chủ trương nghiên cứu và điều tra trừ khi được luận bàn lần đầu giữa FitzGerald và bốn cộng tác viên. [ 121 ] Nó đã giúp ngăn ngừa sự sự không tương đồng và kết nối nghiên cứu và điều tra với trách nhiệm công khai minh bạch của Connaught .Ban đầu, Macleod và Banting miễn cưỡng ĐK bằng bản quyền sáng tạo tiến trình của họ về insulin với nguyên do y đức. Tuy nhiên, vẫn còn quan ngại rằng một bên thứ ba tư nhân sẽ chiếm quyền điều khiển và tinh chỉnh và độc quyền điều tra và nghiên cứu ( như Eli Lilly và Công ty đã từng làm [ 122 ] ), và phân phối bảo đảm an toàn sẽ khó bảo vệ nếu không có năng lực trấn áp chất lượng. Cuối cùng, Edward Calvin Kendall đã đưa ra lời khuyên có giá trị. Ông đã phân lập thyroxin tại Phòng khám Mayo vào năm 1914 và được cấp bằng bản quyền sáng tạo cho quy trình này trải qua sự sắp xếp giữa ông, bạn bè Mayo và Đại học Minnesota, chuyển giao bằng bản quyền sáng tạo cho trường ĐH công lập. [ 123 ] Vào ngày 12 tháng 4, Bilt, Best, Collip, Macleod và FitzGerald đã viết thư cho quản trị của Đại học Toronto để yêu cầu một thỏa thuận hợp tác tương tự như với mục tiêu giao văn bằng bản quyền trí tuệ cho Hội đồng Thống đốc của Đại học. [ 124 ] Bức thư nhấn mạnh vấn đề rằng : [ 125 ]
- Bằng sáng chế sẽ không được sử dụng cho bất kỳ mục đích nào khác ngoài việc ngăn chặn việc lấy bằng sáng chế của người khác. Khi các chi tiết về phương pháp chuẩn bị được công bố, bất kỳ ai cũng có thể tự do chuẩn bị chiết xuất, nhưng không ai có thể đảm bảo độc quyền có lợi nhuận.
Việc chuyển nhượng cho Hội đồng Thống đốc Đại học Toronto được hoàn thành vào ngày 15 tháng 1 năm 1923, với khoản thanh toán mã thông báo là 1 đô la.[126] Sự sắp xếp đã được chúc mừng trong Công trình Thế giới năm 1923 là “một bước tiến trong y đức”.[127] Nó cũng đã nhận được nhiều sự chú ý của truyền thông trong những năm 2010 liên quan đến vấn đề chăm sóc sức khỏe và khả năng chi trả thuốc.
Sau những lo lắng khác tương quan đến nỗ lực của Eli Lilly trong việc tách riêng những phần văn bằng bản quyền trí tuệ của quá trình sản xuất, Trợ lý Giám đốc và Trưởng phòng Insulin của Connaught, Robert Defries đã thiết lập một chủ trương tổng hợp văn bằng bản quyền trí tuệ, nhu yếu những nhà phân phối san sẻ tự do bất kể nâng cấp cải tiến nào trong quy trình sản xuất mà không tác động ảnh hưởng đến năng lực chi trả. [ 128 ]
Phân tích và tổng hợp cấu trúc[sửa|sửa mã nguồn]
Insulin có nguồn gốc từ động vật hoang dã được tinh chế bắt đầu là loại insulin duy nhất có sẵn cho những thí nghiệm và bệnh nhân tiểu đường. John Jacob Abel là người tiên phong tạo ra dạng kết tinh của nó vào năm 1926. [ 129 ] Bằng chứng về thực chất protein được đưa ra tiên phong bởi Michael Somogyi, Edward A. Doisy và Philip A. Shaffer vào năm 1924. [ 130 ] Nó đã được chứng tỏ khá đầy đủ khi Hans Jensen và Earl A. Evans Jr. cô lập những amino acid phenylalanine và proline vào năm 1935. [ 131 ]Cấu trúc amino acid của insulin được đặc trưng lần tiên phong vào năm 1951 bởi Frederick Sanger, [ 13 ] [ 132 ] và insulin tổng hợp tiên phong được sản xuất đồng thời trong phòng thí nghiệm của Panayotis Katsoyannis tại Đại học Pittsburgh và Helmut Zahn tại Đại học RWTH Aachen ở giữa – 1960 [ 133 ] [ 134 ] [ 135 ] [ 136 ] [ 137 ] Insulin bò tinh thể tổng hợp đã đạt được bởi những nhà nghiên cứu Trung Quốc vào năm 1965. [ 138 ] Cấu trúc 3 chiều hoàn hảo của insulin được xác lập bằng tinh thể học tia X trong phòng thí nghiệm của Dorothy Hodgkin năm 1969. [ 139 ]
Loại insulin “người” tổng hợp biến đổi gen đầu tiên được sản xuất bằng E. coli vào năm 1978 bởi Arthur Riggs và Keiichi Itakura tại Viện nghiên cứu Beckman của Thành phố Hope hợp tác với Herbert Boyer tại Genentech.[9][10] Genentech, được thành lập bởi Swanson, Boyer và Eli Lilly và Company, đã tiếp tục vào năm 1982 để bán insulin sinh tổng hợp có sẵn trên thị trường dưới tên Humulin.[10] Phần lớn insulin hiện đang được sử dụng trên toàn thế giới hiện nay là insulin “người” tái tổ hợp sinh học hoặc các chất tương tự của nó.[140] Gần đây, một cách tiếp cận khác đã được sử dụng bởi một nhóm các nhà nghiên cứu tiên phong ở Canada, sử dụng một cây rum dễ trồng, để sản xuất insulin rẻ hơn nhiều.[141]
Insulin tái tổ hợp được sản xuất hoặc trong nấm men (thường là Saccharomyces cerevisiae) hoặc E. coli.[142] Trong nấm men, insulin có thể được thiết kế dưới dạng protein chuỗi đơn với endoprotease KexII (tương đồng men của PCI / PCII) tách chuỗi insulin A ra khỏi chuỗi insulin B bị cắt ngắn. Một đuôi C được tổng hợp hóa học sau đó được ghép vào insulin bằng cách phân giải protein ngược bằng cách sử dụng trypsin protease rẻ tiền; thông thường, lysine trên đuôi C được bảo vệ với nhóm bảo vệ hóa học để ngăn chặn sự phân giải protein. Sự dễ dàng của tổng hợp mô-đun và sự an toàn tương đối của các sửa đổi trong khu vực đó chiếm các chất tương tự insulin phổ biến với sửa đổi đầu C (ví dụ: lispro, aspart, glulisine). Sự tổng hợp Genentech và tổng hợp hóa học hoàn toàn như Bruce Merrifield không được ưa thích vì hiệu quả tái hợp hai chuỗi insulin thấp, chủ yếu là do sự cạnh tranh với sự kết tủa của chuỗi insulin B.
Các giải Nobel[sửa|sửa mã nguồn]
Ủy ban phần thưởng Nobel năm 1923 đã ghi nhận việc trích xuất insulin thực tiễn cho một nhóm nghiên cứu và điều tra tại Đại học Toronto và trao phần thưởng Nobel cho hai người đàn ông : Frederick Banting và JJR Macleod. [ 143 ] Họ đã được trao phần thưởng Nobel về sinh lý học hoặc y học năm 1923 vì phát hiện ra insulin. Banting, cho rằng Best không được đề cập, [ 144 ] đã san sẻ phần thưởng của mình với Best, và Macleod ngay lập tức san sẻ phần thưởng của mình với James Collip. Bằng sáng chế về insulin đã được bán cho Đại học Toronto với giá một đô la .Hai phần thưởng Nobel khác đã được trao cho khu công trình về insulin. Nhà sinh vật học phân tử người Anh Frederick Sanger, người đã xác lập cấu trúc chính của insulin vào năm 1955, đã được trao phần thưởng Nobel về hóa học năm 1958. [ 13 ] Rosalyn Sussman Yalow đã nhận được phần thưởng Nobel về y học năm 1977 vì sự tăng trưởng của giải pháp miễn dịch phóng xạ cho insulin .Một số phần thưởng Nobel cũng có mối liên hệ gián tiếp với insulin. George Minot, đồng nhận phần thưởng Nobel năm 1934 vì đã tăng trưởng chiêu thức điều trị hiệu suất cao tiên phong cho bệnh thiếu máu ác tính, bị đái tháo đường. Tiến sĩ William Castle quan sát thấy rằng việc phát hiện ra insulin năm 1921, đến kịp thời để giữ cho Minot sống, do đó cũng chịu nghĩa vụ và trách nhiệm cho việc phát hiện ra một giải pháp chữa bệnh thiếu máu ác tính. [ 145 ] Dorothy Hodgkin đã được trao phần thưởng Nobel về hóa học năm 1964 vì sự tăng trưởng của tinh thể học, kỹ thuật mà bà đã sử dụng để giải thuật cấu trúc phân tử hoàn hảo của insulin vào năm 1969. [ 139 ]
Công trình được xuất bản bởi Banting, Best, Collip và Macleod đại diện cho việc chuẩn bị chiết xuất insulin tinh khiết phù hợp để sử dụng cho bệnh nhân.[146] Mặc dù Paulescu đã khám phá ra các nguyên tắc điều trị, chiết xuất nước muối của ông không thể được sử dụng trên người; ông đã không được đề cập trong giải thưởng Nobel năm 1923. Giáo sư Ian Murray đặc biệt tích cực trong việc làm việc để sửa chữa “sai lầm lịch sử” chống lại Nicolae Paulescu. Murray là giáo sư sinh lý học tại Đại học Y khoa Anderson ở Glasgow, Scotland, trưởng khoa Bệnh chuyển hóa tại một bệnh viện hàng đầu ở Glasgow, phó chủ tịch Hiệp hội Tiểu đường Anh, và là thành viên sáng lập của Liên đoàn Đái tháo đường Quốc tế. Murray đã viết:
- Sự công nhận không đầy đủ đã được trao cho Paulescu, nhà khoa học nổi tiếng người Rumani, lúc đó, khi nhóm nghiên cứu ở Toronto đang bắt đầu nghiên cứu, họ đã thành công trong việc chiết xuất hormone chống đái tháo đường của tuyến tụy và chứng minh hiệu quả của nó trong việc giảm chứng tăng đường huyết ở chó mắc bệnh tiểu đường.[147]
Trong một cuộc trao đổi riêng tư, Giáo sư Arne Tiselius, cựu viện trưởng Viện Nobel, bày tỏ quan điểm cá thể rằng Paulescu cũng xứng danh với phần thưởng năm 1923. [ 148 ]
- Hormone Glucagon
- Hormone Adrenaline
- Hormone Cortisol
Liên kết ngoài[sửa|sửa mã nguồn]
Source: https://dvn.com.vn
Category: Bản Tin DVN






