Số oxi hóa, hướng dẫn cách tính và áp dụng vào phản ứng – W3CHEM
Mục Lục
1. Vì sao nói số oxi hóa là 1 số lượng giả bộ ?
Mình đã học hai loại liên kết hóa học chủ yếu: Liên kết ion; Liên kết cộng hóa trị. Bây giờ khi tính số oxi hóa, người ta giả bộ …tất cả mọi phân tử trên cuộc đời này đều chỉ hoàn toàn 100% là liên kết ion luôn; nghĩa là mọi hạt trong phân tử bất kỳ đều là ion dương hoặc ion âm!
Và như vậy, số oxi hóa đơn giản chính là điện tích của “ION” đó. Vấn đề còn lại chỉ là cách viết khác nhau để phân biệt giữa điện tích với số oxi hóa.
Bạn hãy xem bảng sau ; và tự đưa ra nhận xét :
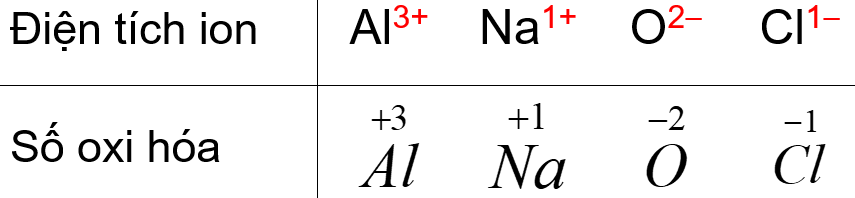 Photo : TrongToan on W3chem
Photo : TrongToan on W3chem
2. Số oxi hóa = Điện tích ion. Dễ quá phải không quý dzị ?
2.1. Soh của đơn chất ; của hợp chất bằng 0
Vì số oxi hóa bằng điện tích ; mà điện tích của đơn chất, hợp chất đương nhiên bằng 0 ; do vậy điều này là đương nhiên thôi. Ví dụ ,
- Soh của đơn chất: kim loại Na, Mg, Al; khí O2, N2, Cl2, …bằng 0.
- Soh của hợp chất: NO, NO2, HNO3, H2SO4, Al(NO3)3, …bằng 0.
2.2. Trong hợp chất, soh của ion đơn nguyên tử = điện tích
Thông dụng
- Ion Li+ Na+ K+ Ag+ là +1
- Ion Be2+ Mg2+ Ca2+ Ba2+ Zn2+ là +2
- Ion Al3+ là +3
- Ion F– là
-1 (soh duy nhất của flo)
Chỉ trong hợp chất với H, với Kim loại, với Phi kim có độ âm điện nhỏ hơn thì
- ion Cl– Br– I– là -1
- ion S2- là -2
Oxi trong hợp chất
- thông dụng O2- có soh là -2
- nhưng trong O2F2 là +1 ; trong OF2 là +2 ; trong H2O2 là -1 ; trong KO2 là -1/2
Hydro trong hợp chất
- thông dụng H1+ có soh là +1
- nhưng trong NaH, CaH2 lại là -1
Các sắt kẽm kim loại có nhiều số oxi hóa, hay gặp
- Cu+ là +1 ; Cu2+ là +2
- Fe2+ là +2 ; Fe3+ là +3
- Cr2+ là +2 ; Cr3+ là +3 ; Cr6+ là +6
2.3. Trong hợp chất, soh của ion đa nguyên tử = điện tích
- Amoni NH4+ là + 1.
- Nitrat NO3– ; Nitrit NO2– ; Perclorat ClO4– ; Clorat ClO3– ; Clorit ClO2– ; Hipoclorir ClO– là – 1.
- Sunfat SO42- ; Sunfit SO32- ; Cacbonat CO32- là – 2.
- Photphat PO43- là – 3.
3. Cách tính số oxi hóa dựa trên những số đã biết
Tính số oxi hóa của một nguyên tố trong phân tử hợp chất hoặc ion đa nguyên tử như sau :
3.1. Tính số oxi hóa của nguyên tố trong phân tử
- Ví dụ mình hãy tính soh của Nitơ trong phân tử NO, NH3, NO2, N2O, N2O3, N2O4, HNO3, HNO2, NaNO3. Mìnhđặt số oxi hóa của N là chữ a; số oxi hóa của O, H, Na đã có là – 2, + 1, + 1 ( mình tra ở mục trên ). Khi đó :
NO | a. 1 + ( – 2 ). 1 = 0 ⇒ a = + 2
NH3 | a. 1 + ( + 1 ). 3 = 0 ⇒ a = – 3
NO2 | a. 1 + ( – 2 ). 2 = 0 ⇒ a = + 4
N2O | a. 2 + ( – 2 ). 1 = 0 ⇒ a = + 1
N2O3 | a. 2 + ( – 2 ). 3 = 0 ⇒ a = + 3
N2O4 | a. 2 + ( – 2 ). 4 = 0 ⇒ a = + 4
HNO3 | ( + 1 ). 1 + a. 1 + ( – 2 ). 3 = 0 ⇒ a = + 5
HNO2 | ( + 1 ). 1 + a. 1 + ( – 2 ). 2 = 0 ⇒ a = + 3
NaNO3 | ( + 1 ). 1 + a. 1 + ( – 2 ). 3 = 0 ⇒ a = + 5
- BT1. Tính soh của lưu huỳnh trong phân tử H2S, SO2, SO3, H2SO3, H2SO4, BaSO4.
- BT2. Tính soh của clo trong phân tử HCl, FeCl2, FeCl3, Cl2O, Cl2O3, Cl2O5, Cl2O7, HClO, HClO2, HClO3, HClO4, KClO3.
- BT3. Tính soh của sắt trong phân tử FeO, Fe2O3, Fe3O4, FeS (coi chừng FeS2).
Hãy xem đáp án sau khi làm bài xong mới ngoan.
Chúc mừng bạn đã kiên trì trong bài rèn luyện này . Photo : TrongToan on W3chem
Photo : TrongToan on W3chem
3.2. Tính số oxi hóa của nguyên tố trong ion
- Ví dụ tính soh của S trong ion SO32- ; SO42- ; HSO3– ; HSO4–. Mìnhđặt số oxi hóa của S là chữ a; số oxi hóa của O, H đã có là – 2, + 1 ( tra ở mục trên ). Khi đó :
SO32- | a.1 + (-2).3 = -2 ⇒ a = +4
SO42- | a.1 + (-2).4 = -2 ⇒ a = +6
HSO3– | (+1).1 + a.1 + (-2).3 = -1 ⇒ a = +4
HSO4– | (+1).1 + a.1 + (-2).4 = -1 ⇒ a = +6
- BT1. Tính soh của N trong ion NO3– ; NO2– ; NH4+ ; trong phân tử NH4NO3 ; NH4NO2.
- BT2. Tính soh của P trong ion PO43- ; HPO42- ; H2PO4–.
Hãy xem đáp án sau khi làm bài xong mới ngoan .
Chúc mừng bạn đã kiên trì trong bài rèn luyện này .
 Photo : TrongToan on W3chem
Photo : TrongToan on W3chem4. Vài số oxi hóa hay sai
Bạn hãy dõi theo bảng sau : Photo : TrongToan on W3chem
Photo : TrongToan on W3chem
5. Phân loại phản ứng dựa trên số oxi hóa
5.1. Ghi soh vào 1 phản ứng đơn cử
- Ghi soh của tất cả nguyên tố trong phản ứng đề cho, ví dụ
 Photo : TrongToan on W3chem
Photo : TrongToan on W3chem
- Mình thấy các phản ứng a. b. c. có số oxi hóa đổi khác ⇒ giữ lại các soh đổi; xóa các soh không đổi để đỡ rối con mắt, mình có kết quả nhìn rất gọn đẹp như sau:
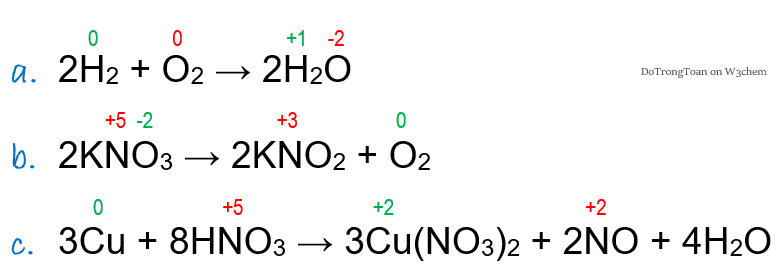 Photo : TrongToan on W3chem
Photo : TrongToan on W3chem
Đương nhiên, bạn dễ dàng thấy ngay: phản ứng d. e. f. có số oxi hóa không đổi; do vậy mình không ghi lại làm gì cho mất công!
5.2. Phân loại phản ứng dựa vào sự đổi khác soh
Dựa trên sự đổi khác soh trước và sau, những phản ứng hóa học được chia thành 2 loại ( dễ hơn rất nhiều so với cách phân loại phản ứng lúc ta còn bé – khi học Hóa lớp 8, lớp 9 ! ) :
- Phản ứng không có sự thay đổi số oxi hóa, ví dụ phản ứng d, e, fở trên.
- Phản ứng có sự thay đổi số oxi hóa (ví dụ phản ứng a, b, c ở trên), còn gọi là PHẢN ỨNG OXI HÓA-KHỬ.
Nếu bạn chú ý trong mỗi phản ứng oxi hóa-khử a, b, c đều có số oxi hóa tăng và số oxi hóa giảm.
Để hiểu nhiều hơn về phản ứng oxi hóa-khử ; mời bạn đọc câu truyện ly kì tiếp theo : Ai … phản ứng oxi hóa khử đây .
6. Liên kết nhanh
Đọc thêm những bài viết về Phản ứng oxi hóa-khử và Hóa lớp 10 tại đây .
Nếu có câu hỏi hoặc sáng tạo độc đáo mới, hãy lưu lại trong phần phản hồi bạn nhé. Câu hỏi và sáng tạo độc đáo của bạn luôn tuyệt vời .
Cũng đừng quên san sẻ bài viết lên mạng xã hội để nhiều người cùng học nha bạn .
Xem thêm: Hướng dẫn chọn mua nồi cơm điện
Chia sẻ bài viết lên mạng xã hội
Continue Reading
Source: https://dvn.com.vn
Category: Cảm Nang






